III M-MLV反轉錄酶,即 III M-MLV reverse transcriptase,是一種經過改造和優化的快速高效(短至10min完成反轉錄)、熱穩定(高達55℃)、高精確度、產物超長(長達12kb)的反轉錄酶,具有正常的依賴于RNA或DNA模板的DNA聚合酶活性,能夠以RNA或DNA為模板,在引物存在的情況下進行互補DNA鏈的合成,即可以進行cDNA(complementary DNA)的第一鏈合成。同時本反轉錄酶保留了RNase H活性,能選擇性剪切RNA和DNA雜合雙鏈中的RNA,有利于后續cDNA第二鏈的合成。
本產品是最常用的優質反轉錄酶之一,廣泛用于獲得總RNA或mRNA后cDNA第一條鏈的合成,后續可以用于PCR、real-time PCR也稱定量PCR(quantitative PCR, qPCR)、cDNA的第二鏈合成以及cDNA文庫的構建,尤其是逆轉錄所得目的基因的克隆等。 III M-MLV反轉錄酶還可以通過反轉錄用于DNA探針的熒光、生物素、地高辛或同位素標記等,也可以通過引物延伸(primer extension)來分析和研究RNA。
M-MLV (Moloney Murine Leukemia Virus),也稱MMLV或M-MuLV;反轉錄酶(reverse transcriptase)也稱逆轉錄酶或RT酶。
本產品反轉錄快速高效,普通反轉錄僅需10min。實測小于3kb的片段,42℃反轉錄10min即可完成,與反轉錄60min相比無顯著差別。大于3kb的片段,特別是大于6kb的片段,推薦反轉錄60min,以獲得最佳的反轉錄效果。
本產品反轉錄產物長度超長。本產品經測試可以輕松完成長度為8 kb以下基因的反轉錄(參考圖1),反轉錄的最大長度可以達到12 kb。
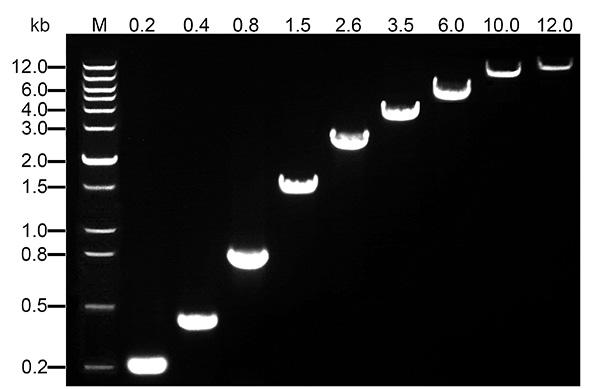
圖1. 使用 III M-MLV反轉錄酶反轉錄總RNA后,對于不同長度的cDNA進行PCR擴增后的電泳效果圖。圖中可見0.2-12kb的cDNA可以非常高效地被反轉錄。
本產品熱穩定性好,反轉錄效率高。本產品最適反應溫度為42℃,當溫度達到50℃時仍具有很高活性,對于長度較短的cDNA反轉錄,溫度達到55℃時也可獲得較高產量的cDNA。高溫反轉錄對于高GC含量RNA的反轉錄,能有效減少二級結構,提升反轉錄效率。本產品反轉錄速度快,6kb以下的cDNA反轉錄只需0.5h即可完成,3kb以下的cDNA反轉錄10min即可完成(參考圖2)。
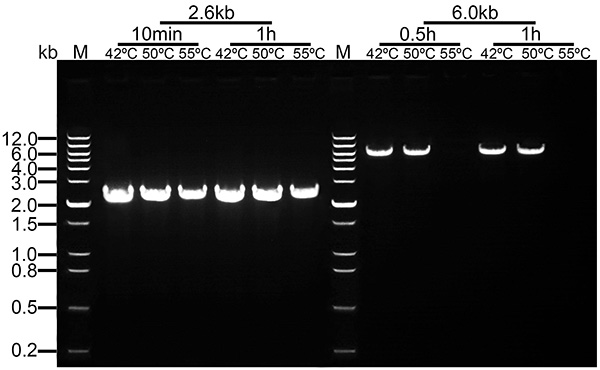
圖2. BIII M-MLV反轉錄酶在不同溫度反應不同時間的反轉錄效果。從HEK293T細胞抽提獲得的總RNA 2µg,在20μl反轉錄體系中按照圖中所示溫度、時間進行反轉錄。反轉錄后取1μl反轉錄產物進行目的基因(2.6kb的YWHAZ基因和6.0kb的ADAR1基因)的PCR擴增和電泳。
本產品性價比高。III M-MLV反轉錄酶是一種大腸桿菌重組高表達的反轉錄酶,由于其表達量非常高,大大提高了本產品的性價比。本反轉錄酶為表達含有從Moloney Murine Leukemia Virus reverse transcriptase基因克隆的pol基因,并進行了多個突變優化以提高其熱穩定性、反轉錄效率、反轉錄長度和表達量。
酶活性定義:One unit of the enzyme incorporates 1 nmol of dTTP into acid-precipitable material in 10 min at 37℃ using poly(A)•oligo(dT)12-18 as template-primer。反應體系為 50 mM Tris-HCl(pH 8.3), 75 mM KCl, 3 mM MgCl2, 10 mM DTT, 0.5mM [3H]-dTTP and 0.4 mM polyA•oligo(dT)12-18。
純度:不含DNA內切酶、外切酶和磷酸酯酶和RNA酶,可以滿足常規反轉錄合成cDNA第一條鏈等的需要。
酶儲存溶液:20 mM Tris-HCl (pH 7.5), 100 mM NaCl, 0.1 mM EDTA, 1 mM DTT, 0.01%(v/v)
NP-40 and 50%(v/v) glycerol。
失活或抑制:80℃孵育10分鐘可以導致 III M-MLV反轉錄酶失活;EDTA、EGTA等螯合劑、無機磷酸鹽或焦磷酸鹽以及聚氨(polyamine)對 III M-MLV反轉錄酶有抑制作用。
本產品中M-MLV反轉錄酶的濃度為200U/µl,用于體積為20μl的反轉錄體系時,本試劑盒的不同包裝足夠分別進行50次、250次和1000次反轉錄反應。
包裝清單:
| 產品編號 | 產品名稱 | 包裝 |
| D7176S-1 | III M-MLV反轉錄酶 | 50μl |
| D7176S-2 | Reaction Buffer (5X) | 0.3ml |
| — | 說明書 | 1份 |
保存條件:
-20℃保存。
注意事項:
對于GC含量比較高的RNA的反轉錄,產品的使用說明中給予了特別說明,請予以關注。
本產品僅限于專業人員的科學研究用,不得用于臨床診斷或治療,不得用于食品或藥品,不得存放于普通住宅內。
為了您的安全和健康,請穿實驗服并戴一次性手套操作。
使用說明:
1. cDNA第一條鏈的合成(First-stand cDNA Synthesis):
a. 參考如下表格中設置的20μl反轉錄體系(RNase Inhibitor (R0102)和dNTP mix (D7373)可從訂購):
| 模板(右側3種任選其中一種) | Total RNA | 0.1 ng-5 μg |
| 或poly(A) RNA/mRNA | 10 pg-0.5 μg | |
| 或specific RNA | 0.01 pg-0.5 μg | |
| 引物(右側3種任選其中一種) | Oligo(dT)18 primer | 0.5 μg(或100 pmol) |
| 或 Random Hexamer primer | 0.2 μg(或100 pmol) | |
| 或 gene-specific primer | 15-25 pmol | |
| DEPC-treated Water | - | To 13.7μl* |
| 選擇性步驟:如果模板RNA的GC含量較高(例如大于55%)或者有比較嚴重的二級結構,混勻后微離心以把液體沉降至管底,65℃孵育5min,隨后立即置于冰上冷卻,以打開RNA中一些比較穩定的二級結構。 | ||
| Reaction Buffer (5X) | - | 4 μl |
| RNase Inhibitor (40U/μl) | - | 0.5 μl |
| dNTP Mix (25mM each) | - | 0.8 μl** |
| III M-MLV反轉錄酶 | - | 1 μl |
| 總體積 | 20μl | |
*To 13.7μl表示加入DEPC-treated Water至最終體積為13.7μl。
**dNTP濃度不同時使用的體積需作適當調整,此時DEPC-treated Water的用量需適當調整。
b. 輕輕混勻(用移液器輕輕吹打混勻或用渦旋混合器在最低速度輕輕混勻),隨后離心沉淀液體。
c. 如果使用Oligo(dT)18或基因特異性引物,42℃孵育10-60 min。如果使用random hexamer(隨機六聚體)作為引物,先在25℃孵育10 min,隨后在42℃孵育10-60 min。反轉錄3kb以下的cDNA,反轉錄10min即可,反轉錄3-6kb的cDNA,反轉錄30min即可,而6kb以上的cDNA推薦反轉錄60min。當使用random hexamer(隨機六聚體)作為引物,并且后續用于qPCR時,后續檢測任何長度的基因,均反轉錄10min就足夠了。注意:對于GC含量較高或二級結構比較嚴重的模板RNA,可以50℃孵育60min,以充分利用本產品在50℃時仍有良好的反轉錄酶活性這一特點,在較高溫度進行反轉錄可以有效減少二級結構的干擾。
d. 80℃孵育10 min以失活 III M-MLV反轉錄酶并終止反轉錄反應。說明:對于5kb以上的長片斷cDNA不推薦采用加熱的方法失活反轉錄酶,該方法易導致部分長片斷DNA被剪切,此時可考慮酚氯仿抽提或柱純化方法。
e. 反轉錄產物可以直接用于后續的PCR反應等,也可以-20℃凍存以備以后使用。用于后續PCR反應時,如果PCR的反應體系為20μl和50μl,則推薦相應地使用0.8μl和2μl反轉錄產物。
2. 引物延伸、探針標記等其它用途請自行參考M-MLV反轉錄酶的相關文獻資料進行。
常見問題:
1. 總RNA反轉錄產物電泳觀察不到。
a. 反轉錄產物由于是從模板反轉錄而獲得,而模板的量本身比較低,反轉錄的量通常還要少于模板量,并且總RNA的反轉錄產物大小很不均勻,因此通常總RNA的反轉錄產物直接電泳觀察是觀察不到的。
2. 反轉錄產物通過PCR擴增沒有特異性條帶。
a. PCR擴增沒有獲得特異性條帶時建議先使用actin、GAPDH等作為內參進行PCR擴增,看是否可以成功擴增。如果可以成功,則說明PCR擴增體系沒有問題,此時通常是目的基因的引物設計欠佳,當然也有可能是反轉錄產物質量欠佳。如果內參不能被很好地擴增,則有可能PCR體系存在問題或反轉錄產物質量欠佳。
b. 模板RNA發生了降解。哺乳動物細胞或組織的總RNA瓊脂糖電泳后應該可以看到清晰的18S和28S rRNA條帶,并且28S rRNA和18S rRNA的亮度比例應該大于等于2.0。如果比例小于2.0,則提示總RNA發生了顯著的降解,最好能重新制備總RNA樣品。避免RNA降解的主要方法是,嚴格進行RNA的相關操作,包括帶潔凈手套、戴一次性口罩、在潔凈環境中抽提或制備RNA,以盡量避免RNase污染。
c. 模板RNA的純度偏低。在提取純化RNA的過程中,殘留在溶液中的一些成分如苯酚、SDS、EDTA、胍鹽、磷酸、焦磷酸、多胺、亞精胺等會抑制反轉錄酶活性。對RNA樣品進行柱純化,或者進行沉淀、洗滌和再溶解,通常可以有效去除殘留的污染物。通常選擇使用BeyoZol或Trizol抽提獲得的總RNA完全可以滿足反轉錄反應的需要。
d. 反轉錄反應的模板量不足。在抽提獲得總RNA后,在進行一些精細的定量檢測時通常會進行DNase I消化,以充分去除可能的殘留的DNA的干擾。DNase I進行熱失活時,需要加入EDTA至終濃度為2.5mM,否則RNA在沒有螯合劑的情況下,在加熱過程中容易被水解,從而導致模板量不足。此外,擴增特定基因時,需要先查詢該基因的組織分布特點,利用其高表達的組織進行目的基因的反轉錄和克隆。用該基因豐度極低的組織或細胞樣品進行反轉錄和PCR擴增,通常會由于模板量過少而PCR擴增失敗。
e. 沒有使用適當的反轉錄引物。對于細菌RNA和不含poly(A)尾巴的RNA,要用random hexamer引物代替Oligo(dT)18引物。使用基因特異性反轉錄引物時,需要確保基因特異性引物設計合理正確。
f. 如果RNA模板富含GC或容易形成二級結構,此時可以考慮把反轉錄溫度提高到45-55℃









