溶酶體β-半乳糖苷酶染色試劑盒(Lysosomal β-Galactosidase Staining Kit)是一種對溶酶體中酸性β-半乳糖苷酶(Acid β-Galactosidase)進行染色檢測的試劑盒,常用作細胞衰老檢測時的對照。在普通的光學顯微鏡下就可以觀測到細胞或組織中溶酶體酸性β-半乳糖苷酶的活力水平情況。本試劑盒可以用于培養細胞的檢測,也可以用于組織切片的檢測。
絕大多數正常細胞都可以檢測到較高水平的溶酶體β-半乳糖苷酶活性水平。可以用作細胞衰老β-半乳糖苷酶染色時的參考染色。細胞衰老特異的β-半乳糖苷酶僅在衰老時表達,而溶酶體β-半乳糖苷酶幾乎在任何情況下都表達。
溶酶體β-半乳糖苷酶染色試劑盒,以X-Gal為底物,在溶酶體酸性β-半乳糖苷酶的催化下會生成深藍色產物。從而在光學顯微鏡下很容易觀察到變成藍色的表達β-半乳糖苷酶的細胞或組織。本產品染色后的HeLa細胞請參考圖1。
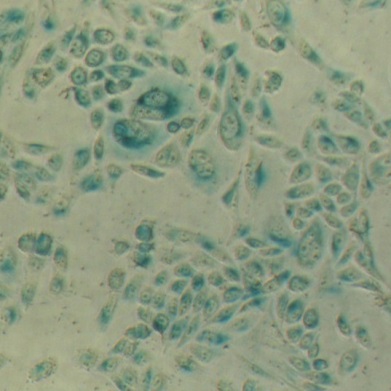
圖1. HeLa細胞使用本產品染色后的示例圖片。
本試劑盒僅染色溶酶體酸性β-半乳糖苷酶,不會染色衰老特異性的β-半乳糖苷酶,也不會染色外源轉染表達的用于報告基因的β-半乳糖苷酶(大腸桿菌的β-半乳糖苷酶)。
主要特點:本試劑盒經過多方面的優化,是同類產品中首創的能兼容普通的細胞培養用多孔板、移液管等聚苯乙烯類材質耗材或容器的試劑盒。本試劑盒可以有效避免由于和多孔板、移液管等的不兼容導致的染色偏弱、染色效果不穩定等情況。通常同類試劑盒要求使用可高溫高壓滅菌的聚丙烯(polypropylene)材質的耗材、容器或玻璃容器進行溶液的配制,而不能使用普通的多孔板、移液管等聚苯乙烯(polystyrene)類材質的容器或耗材,否則可能會出現絮狀沉淀,影響實驗觀察。即使嚴格按照要求操作,也會在染色時間比較長的情況下,容易出現絮狀物沉淀(參考圖2)。本試劑盒經過多方面的優化,對耗材或容器的材質無特殊要求,可以兼容普通的多孔板和移液管等常用耗材和容器。而且配制的工作液不會產生沉淀或不溶物,使用更加便捷。
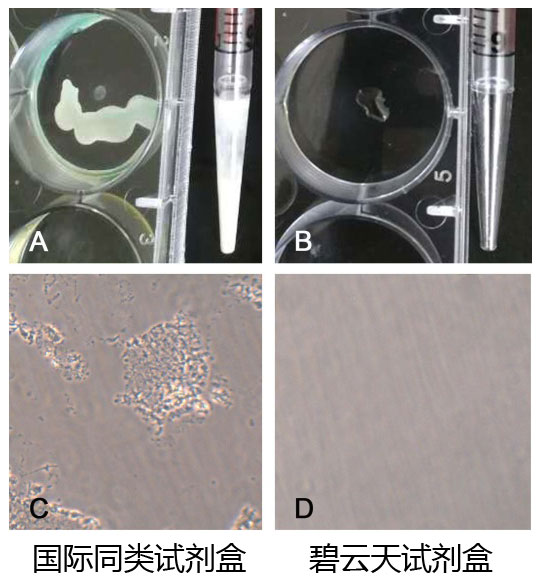
圖2. 本試劑盒優化前后的對比圖。優化前,X-Gal溶液直接接觸聚苯乙烯類材質的材料如移液管、多孔板等會產生明顯的腐蝕(A圖),使用聚苯乙烯容器配制染色工作液后,在顯微鏡下觀察有異常的絮狀不溶物(C圖);優化后,X-Gal溶液直接接觸聚苯乙烯類材質的材料觀察不到有任何異常情況(B圖),使用聚苯乙烯容器配制染色工作液后,在顯微鏡下觀察也沒有任何異常情況(D圖)。
如果使用6孔板檢測,足夠測定100個樣品;使用24孔板測定,足夠測定400個樣品;使用96孔板測定,足夠測定1000個樣品。對于組織切片或組織塊,可以檢測的樣品數量視樣品的大小而定。對于普通切片的滴染足夠檢測100個樣品。
包裝清單:
| 產品編號 | 產品名稱 | 包裝 |
| C0605-1 | β-半乳糖苷酶染色固定液 | 100ml |
| C0605-2 | X-Gal溶液 | 5ml |
| C0605-3 | β-半乳糖苷酶染色液A | 1ml |
| C0605-4 | β-半乳糖苷酶染色液B | 1ml |
| C0605-5 | β-半乳糖苷酶染色液C | 100ml |
| - | 說明書 | 1份 |
保存條件:
-20℃保存,一年有效。其中X-Gal溶液需避光保存。
注意事項:
β-半乳糖苷酶染色固定液對人體有毒、有腐蝕性,操作時請特別小心,并注意有效防護以避免直接接觸人體或吸入體內。
X-Gal溶液在-20ºC或4ºC保存會凍結,室溫或37ºC水浴2-5分鐘并適當搖動即可完全融解。
β-半乳糖苷酶染色液B在剛剛溶解后會觀察到有沉淀,屬正常現象,充分混勻或Vortex后,沉淀會全部溶解。作為常規,試劑使用前必須確保沉淀全部溶解,并且混勻。
使用96孔板等多孔板進行檢測時,如果孵育過夜容易產生所謂的“邊緣效應”(edge effect),即多孔板四周的孔由于和外界最直接接觸,易受外界環境影響,其中最明顯的是四周細胞培養孔的蒸發效應。邊緣效應會導致細胞生長不均勻、細胞分布不均一、培養液體積不一致、培養液中相關成分的濃度、pH值不一致。建議采取以下方法避免96孔板等多孔板的邊緣效應:避免孵育過長時間,以避免蒸發等帶來的邊緣效應;棄用邊緣孔并在棄用的邊緣孔中加入等量的水、PBS或其他適當溶液;在多孔板非孔的凹陷處加入適量的水或其他適當溶液;將整塊板放在濕盒中;使用防揮發蓋;在實驗設計時,實驗樣品最好進行隨機分配,不要將某一組樣品固定放在某個位置而引入可能的系統性誤差。
需自備PBS或HBSS(Hanks Balanced Salt Solution)。
本產品僅限于專業人員的科學研究用,不得用于臨床診斷或治療,不得用于食品或藥品,不得存放于普通住宅內。
為了您的安全和健康,請穿實驗服并戴一次性手套操作。
使用說明:
1. 對于貼壁細胞:
a. 對于6孔板中培養的細胞,吸除細胞培養液,用PBS或HBSS洗滌1次,加入1毫升β-半乳糖苷酶染色固定液,室溫固定15分鐘。對于其它類型的培養板,固定液及后續溶液的用量參照此比例進行操作。
b. 吸除細胞固定液,用PBS或HBSS洗滌細胞3次,每次3分鐘。
c. 吸除PBS或HBSS,每孔加入1毫升染色工作液。染色工作液的配制方法參考表1。
表1. 染色工作液的配制方法。
| β-半乳糖苷酶染色液A | 10μl |
| β-半乳糖苷酶染色液B | 10μl |
| β-半乳糖苷酶染色液C | 930μl |
| X-Gal溶液 | 50μl |
d. 37℃孵育過夜,可以用parafilm或保鮮膜封住6孔板防止蒸發。
e. 普通光學顯微鏡下觀察。如不能及時觀察計數,可以去除染色工作液,加入2毫升PBS,4℃可以保存數天;或者加上封片液封片后,4℃可以保存較長時間。
2. 對于懸浮細胞:
a. 離心收集細胞至1.5ml離心管內,用PBS或HBSS洗滌1次,加入1毫升β-半乳糖苷酶染色固定液,室溫固定15分鐘。固定時可以在搖床上緩慢搖動,以避免細胞結成團塊。
b. 離心,吸除細胞固定液,用PBS或HBSS洗滌細胞3次,每次3分鐘。
c. 離心,吸除PBS或HBSS,每管加入0.5-1毫升染色工作液。染色工作液的配制方法參考表1。
d. 37℃孵育過夜。
e. 取部分染色后的細胞,滴加到載玻片上或6孔板內,普通光學顯微鏡下觀察。如不能及時觀察計數,可以離心,去除染色工作液,然后加入1毫升PBS,4℃可以保存數天。如果離心,取細胞用于涂片,加上封片液封片后,4℃可以保存較長時間。
3. 對于組織切片:
a. 對于石蠟切片先按照常規方法進行脫蠟和水化處理。對于冷凍切片直接按照以下步驟進行。
b. 加入適當體積的β-半乳糖苷酶染色固定液,以充分蓋住組織為宜,室溫固定不少于15分鐘。
c. 用PBS浸泡洗滌組織3次,每次不少于5分鐘。
d. 吸除PBS,加入適當量的染色工作液。染色工作液的配制方法參考表1。
e. 37℃孵育過夜,可以用parafilm或保鮮膜封住防止蒸發。最好把整個切片浸泡在染色工作液中。
f. 普通光學顯微鏡下觀察。如不能及時觀察,加上封片液封片后4℃可以保存較長時間









