Multiplex PCR Kit,即多重PCR試劑盒,是一種高效、高特異性和高靈敏度的適用于對(duì)多個(gè)(可以超過(guò)20個(gè))目標(biāo)DNA片段同時(shí)進(jìn)行非常均衡的PCR擴(kuò)增的試劑盒。并且本產(chǎn)品不僅可以用于普通的多重PCR,更可以用于全血、血清或植物樣品的直接PCR,便于直接用于血液樣品中細(xì)菌和病毒感染、基因突變等的多重PCR檢測(cè),或者用于植物樣品的基因突變、微生物感染等的多重PCR檢測(cè)。
多重PCR是一種通過(guò)單個(gè)PCR反應(yīng)同時(shí)對(duì)至少兩個(gè)或多個(gè)DNA片段進(jìn)行擴(kuò)增的PCR技術(shù)。目前該技術(shù)已被廣泛應(yīng)用于科學(xué)研究、疾病診斷和法庭或診斷性的基因分型(Genotyping)等多個(gè)領(lǐng)域。該技術(shù)還可以被用于以cDNA為模板的基因定量或半定量的表達(dá)分析,其特別適合于各種動(dòng)植物、真菌、細(xì)菌或病毒等微量樣品進(jìn)行多基因檢測(cè),具備高特異性和高靈敏度的突出優(yōu)點(diǎn)。
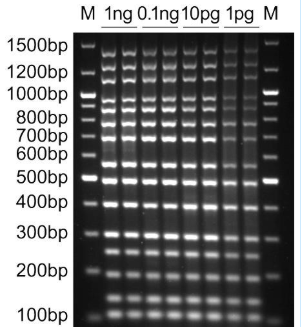
本產(chǎn)品多重?cái)U(kuò)增性能優(yōu)越。本試劑盒實(shí)測(cè)可以輕松實(shí)現(xiàn)15個(gè)目標(biāo)DNA片段的同時(shí)并且非常均衡的高效、高特異性和高靈敏度擴(kuò)增(參考圖1)。對(duì)于低至1pg的模板量,也可以通過(guò)僅30個(gè)PCR循環(huán)而被很好地?cái)U(kuò)增(參考圖1)。普通的PCR試劑盒會(huì)由于PCR擴(kuò)增時(shí)引物和模板的偏好性,對(duì)于不同的引物和不同的模板會(huì)產(chǎn)生不同的擴(kuò)增效率,導(dǎo)致部分片段容易被擴(kuò)增,而部分片段較難被擴(kuò)增。本試劑盒使用了通過(guò)精心篩選和突變優(yōu)化的非常適合用于多重PCR的DNA聚合酶 DNA polymerase和反復(fù)優(yōu)化的配套緩沖液,確保可以實(shí)現(xiàn)多個(gè)目標(biāo)DNA片段的高效、高特異性和高靈敏度的均衡擴(kuò)增。

圖1. Multi™ Multiplex PCR Kit進(jìn)行多重PCR擴(kuò)增的實(shí)測(cè)電泳效果圖。以圖中指定量的Lambda噬菌體基因組DNA為模板,按照本試劑盒的使用說(shuō)明每個(gè)樣品采用20μl PCR擴(kuò)增體系,使用15對(duì)引物進(jìn)行多重PCR擴(kuò)增,每條引物的終濃度為0.2μM,PCR擴(kuò)增條件為:94℃預(yù)變性5min;94℃變性30sec、60℃退火30sec、68℃延伸3min;最后68℃延伸10min;共30個(gè)PCR循環(huán)。PCR結(jié)束后,取2μl擴(kuò)增產(chǎn)物進(jìn)行電泳檢測(cè)。擴(kuò)增的片段從小到大依次為113bp、143bp、199bp、253bp、303bp、406bp、501bp、576bp、710bp、802bp、903bp、989bp、1167bp、1300bp和1463bp。M, DNA marker (D0107 DNA Ladder (0.1-10kb, 21 bands))。圖中可見(jiàn)低至10pg的模板就可以擴(kuò)增獲得15條非常單一明亮的條帶,低至1pg的模板量也能擴(kuò)增獲得比較清晰的15條條帶。同時(shí)可以觀察到在模板量較低、PCR反應(yīng)不完全的情況下,在100bp條帶下方有過(guò)剩的引物條帶存在。
本產(chǎn)品兼容血液和植物樣品。全血或血清樣品無(wú)須進(jìn)行DNA的提取和純化,即可直接作為模板用于本試劑盒的多重PCR檢測(cè)。本產(chǎn)品適用于EDTA、肝素或檸檬酸鈉抗凝血樣品或干血斑樣品。植物樣品也可以直接用于本試劑盒的多重PCR檢測(cè),完全無(wú)須對(duì)植物樣品進(jìn)行DNA的提取和純化。
本產(chǎn)品提供了陽(yáng)性對(duì)照,便于驗(yàn)證本產(chǎn)品的效果。全血或血清樣品無(wú)須進(jìn)行DNA的提取和純化,即可直接作為模板用于本試劑盒的多重PCR檢測(cè)。本產(chǎn)品適用于EDTA、肝素或檸檬酸鈉抗凝血樣品或干血斑樣品。植物樣品也可以直接用于本試劑盒的多重PCR檢測(cè),完全無(wú)須對(duì)植物樣品進(jìn)行DNA的提取和純化。
本產(chǎn)品的擴(kuò)增產(chǎn)物可以用于TA克隆。使用本產(chǎn)品獲得的PCR產(chǎn)物帶有3'-dA overhangs的粘性末端,可直接用于與T載體連接進(jìn)行TA克隆。本產(chǎn)品中所使用的DNA polymerase的保真性和Taq DNA聚合酶相近,因此本產(chǎn)品主要推薦用于定性和半定量檢測(cè)。
DNA polymerase來(lái)源:大腸桿菌重組表達(dá)純化獲得。
DNA polymerase純度:不含DNA內(nèi)切酶、外切酶和磷酸酯酶,不含RNA酶,滿足常規(guī)PCR反應(yīng)要求。
酶儲(chǔ)存溶液:20 mM Tris-HCl (pH 8.0), 1 mM DTT, 0.1 mM EDTA, 100 mM KCl, 0.5% (v/v) Nonidet P40, 0.5% (v/v) Tween 20 and 50% (v/v) glycerol。
失活或抑制:酚氯仿抽提可以使 DNA polymerase失活。
本產(chǎn)品如果用于20μl的PCR反應(yīng)體系,兩種包裝的本產(chǎn)品分別足夠用于100個(gè)和500個(gè)反應(yīng)。
包裝清單:
| 產(chǎn)品編號(hào) | 產(chǎn)品名稱 | 包裝 |
| D7301S-1 | DNA polymerase | 100μl |
| D7301S-2 | 10X PCR Buffer | 250μl |
| D7301S-3 | Control template and primer mix | 25μl |
| — | 說(shuō)明書(shū) | 1份 |
| 產(chǎn)品編號(hào) | 產(chǎn)品名稱 | 包裝 |
| D7301M-1 | DNA polymerase | 500μl |
| D7301M-2 | 10X PCR Buffer | 1.2ml |
| D7301S-3 | Control template and primer mix | 50μl |
| — | 說(shuō)明書(shū) | 1份 |
保存條件:
-20℃保存。
注意事項(xiàng):
引物設(shè)計(jì)對(duì)于多重PCR的成功與否至關(guān)重要。引物的設(shè)計(jì)一方面需要滿足常規(guī)的引物設(shè)計(jì)規(guī)則,避免出現(xiàn)非特異性擴(kuò)增和無(wú)法擴(kuò)增,設(shè)計(jì)好的引物對(duì)應(yīng)逐一通過(guò)PCR驗(yàn)證,然后才能選擇效果較好的引物對(duì)用于多重PCR。并且引物的設(shè)計(jì)在盡可能的情況下,如果Tm值按照Tm = 2n(A) + 2n(T) + 4n(C) + 4n(C)進(jìn)行計(jì)算(例如一條引物含有3個(gè)A、7個(gè)T、4個(gè)G和6個(gè)C,那么Tm = 2X3 + 2X7 + 4X4 + 4X6 = 60),Tm值不能低于60℃,通常按此計(jì)算Tm不低于65℃時(shí)用于多重PCR的效果會(huì)更佳。
推薦使用高質(zhì)量引物(經(jīng)脫鹽處理、PAGE或HPLC純化),建議使用前預(yù)先混合所用所有引物對(duì),調(diào)整各對(duì)引物母液濃度均達(dá)到10μM,最終使其在PCR反應(yīng)體系中終濃度達(dá)0.2μM。
推薦的延伸速度為2min/kb,對(duì)于較難擴(kuò)增的靶序列,可適當(dāng)調(diào)整延伸時(shí)間為3-4min/kb。
如果PCR產(chǎn)物條帶較多,建議PCR反應(yīng)后電泳檢測(cè)的上樣量調(diào)整為約2μl,過(guò)多的上樣量容易導(dǎo)致電泳條帶不太平整。
由于多重PCR反應(yīng)非常靈敏,在使用本產(chǎn)品時(shí)請(qǐng)注意避免微量待擴(kuò)增DNA的污染,建議設(shè)置不加模板的空白對(duì)照以確認(rèn)是否有待擴(kuò)增DNA的污染。
需自備dNTP和Nuclease-Free Water。推薦選購(gòu)D7371 dNTP Mixture (2.5mM each)或D7373 dNTP Mixture (25mM each),以及ST876 Ultrapure Water (DNase/RNase-Free, Sterile)。
對(duì)模板GC含量過(guò)高的情況,推薦使用D7303S PCR Enhancer (2X)。
本產(chǎn)品僅限于專(zhuān)業(yè)人員的科學(xué)研究用,不得用于臨床診斷或治療,不得用于食品或藥品,不得存放于普通住宅內(nèi)。
為了您的安全和健康,請(qǐng)穿實(shí)驗(yàn)服并戴一次性手套操作。
使用說(shuō)明:
1.引物設(shè)計(jì):
引物設(shè)計(jì)對(duì)于成功進(jìn)行多重PCR至關(guān)重要,建議使用適當(dāng)?shù)囊镌O(shè)計(jì)軟件進(jìn)行引物設(shè)計(jì):
a.引物的長(zhǎng)度通常為20-30個(gè)核苷酸。
b.GC含量為40-60% (優(yōu)選45-55%)。
c.避免所用的多個(gè)引物的3'末端出現(xiàn)互補(bǔ)序列,避免引物3'末端有3個(gè)或更多的G / C,避免引物內(nèi)的二級(jí)結(jié)構(gòu)。
d.在盡可能的情況下所用引物的Tm值應(yīng)不低于60℃,推薦在Tm值在65-68℃之間更佳,引物間的Tm值差異應(yīng)控制在5-6℃以內(nèi)。此處提到Tm值按照Tm = 2n(A) + 2n(T) + 4n(C) + 4n(C)進(jìn)行計(jì)算,例如一條引物含有3個(gè)A、7個(gè)T、4個(gè)G和6個(gè)C,那么Tm = 2X3 + 2X7 + 4X4 + 4X6 = 60。
e.建議擴(kuò)增的目標(biāo)片段不超過(guò)1500bp。雖然目標(biāo)片段大約1500bp時(shí)也能被很好地?cái)U(kuò)增,但過(guò)長(zhǎng)的片段和較短的片段同時(shí)進(jìn)行PCR擴(kuò)增的時(shí)候,相對(duì)更容易產(chǎn)生亮度不太均勻的條帶。
f.建議使用經(jīng)過(guò)脫鹽、PAGE或HPLC純化的引物,并溶于TE buffer (10mM Tris-Cl,1mM EDTA, pH 8.0)。
2.引物的配制:
每種合成的引物推薦配制為100µM,然后每個(gè)引物對(duì)1:1混合并加入適量水配制成10µM的引物對(duì)。例如,如果合成得到的一個(gè)5’端引物A的量是20nmol,另外一個(gè)相應(yīng)的3’端引物B的量是19nmol。在引物A中加入200µl水或TE,配制成濃度為100µM,在引物B中加入190µl水或TE也配制成濃度為100µM。吸取20µl 100µM引物A和20µl 100µM引物B到一新的離心管中,再加入160µl水,混勻后即可得到可以直接用于多重PCR的引物對(duì)(10µM each)。
3.多重PCR擴(kuò)增:
a.反應(yīng)體系的設(shè)置。融解并混勻多重PCR反應(yīng)所需的各種溶液。將 DNA polymerase置于冰浴上或冰盒內(nèi)。參考下表設(shè)置PCR反應(yīng)體系。如有多個(gè)類(lèi)似的PCR反應(yīng),可以先配制大體積的包含水、Buffer、dNTP和Multiplex™ DNA polymerase的混合物,然后分裝到各PCR反應(yīng)管內(nèi)。同時(shí)可根據(jù)情況,將多對(duì)引物進(jìn)行等濃度預(yù)混合。
| Component | Sample | Control | Sample | Control | Final concentration |
| Nuclease-Free Water | (15-x-0.4n)μl | 10μl | (37.5-x-n)μl | 25μl | - |
| 10X PCR Buffer | 2μl | 2μl | 5μl | 5μl | 1X |
| dNTP (2.5mM each) | 2μl | 2μl | 5μl | 5μl | 0.25mM each |
| Primer mix (10μM each) | 0.4μl×n | - | 1μl×n | - | 0.2μM each |
| Template | xμl | - | xμl | - | - |
| Control template and primer mix | - | 5μl | - | 12.5μl | - |
| Multiplex™ DNA polymerase | 1μl | 1μl | 2.5μl | 2.5μl | - |
| Total volume | 20μl | 20μl | 50μl | 50μl | - |
注1:n代表多重PCR時(shí)使用的引物對(duì)種類(lèi)的數(shù)量,即擬擴(kuò)增片段種類(lèi)的數(shù)量。
注2:關(guān)于模板使用量。DNA模板的用量對(duì)PCR擴(kuò)增有很大影響。對(duì)于高復(fù)雜度的DNA樣本,如哺乳動(dòng)物基因組DNA,推薦在20μl反應(yīng)體系中使用5ng至0.5μg模板DNA。對(duì)于低復(fù)雜度的DNA,如λDNA或質(zhì)粒DNA,推薦在20μl反應(yīng)體系中使用5pg至5ng的模板DNA。
注3:關(guān)于PCR模板為抗凝血的情況。PCR模板為抗凝血時(shí),模板的用量一般為PCR反應(yīng)體系總體積的1-20%,建議起始使用量為5%;如果抗凝血多重PCR反應(yīng)檢測(cè)的是基因組的DNA片段,可以適當(dāng)減少抗凝血用量;如果抗凝血多重PCR反應(yīng)檢測(cè)的是血液樣品中某種病毒或細(xì)菌等微生物的目的DNA片段,建議使用50μl的PCR體系,并使用較大的模板血量。對(duì)于高GC含量的PCR擴(kuò)增,可以使用擴(kuò)增高GC含量DNA片段的D7303S PCR Enhancer (2X),或者嘗試向PCR體系中加入終濃度1-10% (體積百分比)的DMSO。對(duì)于干血斑樣品,20μl和50μl的PCR體系中分別推薦使用約0.8平方毫米和2平方毫米的干血斑。
注4:關(guān)于PCR模板為植物樣品的情況。PCR模板為抗凝血時(shí),對(duì)于20μl和50μl PCR反應(yīng)體系,植物樣品的推薦用量分別為0.1-1mm和0.3-3mm直徑葉片或類(lèi)似大小其它比較柔嫩的植物組織。如果模板為植物種子,盡量使用鮮嫩的植物種子。用干凈的解剖刀去掉種子外殼,剪下直徑約0.5-2mm的組織直接放入PCR管內(nèi);若種子太小,如番茄種子,可直接使用1-2粒完整的種子放入PCR管內(nèi)進(jìn)行擴(kuò)增。50μl PCR體系,植物葉片或是種子直徑不宜超過(guò)3mm,太多模板易造成PCR抑制成分偏多,影響PCR效果。推薦取兩份植物組織樣品進(jìn)行平行的PCR實(shí)驗(yàn),以降低取樣的不穩(wěn)定性。為確保取樣的均一性,建議使用專(zhuān)用的打孔器或解剖刀進(jìn)行取樣,并注意防止取樣過(guò)程中的交叉污染。每一次取樣,可以用2%的次氯酸鈉溶液清洗打孔器或解剖刀。對(duì)于高GC含量的PCR擴(kuò)增,可以嘗試向PCR體系中加入終濃度1-10% (體積百分比)的DMSO。
注5:關(guān)于引物濃度。通常引物的終濃度為0.2μM時(shí)可獲得良好的PCR擴(kuò)增效果,但也可以根據(jù)情況在0.05-0.4μM范圍內(nèi)調(diào)整引物的終濃度。擴(kuò)增效率低的情況下,可提高引物濃度;發(fā)生非特異性擴(kuò)增時(shí),可降低引物濃度。
b.用移液器輕輕吹打混勻或輕微Vortex混勻,室溫離心數(shù)秒,使液體積聚于管底。
c.如果所使用的PCR儀有熱蓋則省略本步驟。如果PCR儀沒(méi)有熱蓋,則在管內(nèi)滴入一滴礦物油(ST275 Mineral oil (礦物油))。
d.把設(shè)置好的PCR反應(yīng)體系置于PCR儀上,開(kāi)始PCR反應(yīng)。PCR反應(yīng)的設(shè)置可以參考如下表格。
| Step | Cycles | Temperature | Time | Description |
| 1 | - | 94℃ | 5min | Initial denaturation |
| 2 | 30-40 | 94℃ | 30sec | Denaturation |
| 60℃ | 30sec | Annealing | ||
| 68℃ | 2min/kb | Extension | ||
| 3 | - | 68℃ | 10min | Final extension |
| 4 | - | 4℃ | Forever | Hold |
注1:需根據(jù)每次反應(yīng)的模板、引物、PCR產(chǎn)物的長(zhǎng)度和GC含量等適當(dāng)優(yōu)化PCR反應(yīng)條件,包括退火溫度、退火時(shí)間、循環(huán)數(shù)等。通常退火溫度可在55-60℃范圍內(nèi)適當(dāng)調(diào)整,或者可以對(duì)退火溫度采用Touch down的方式,確保退火效果良好。
注2:對(duì)于初次進(jìn)行的PCR,為盡量確保可以擴(kuò)增出預(yù)期的PCR產(chǎn)物,可以把循環(huán)數(shù)設(shè)置為35。后續(xù)可以根據(jù)實(shí)際的PCR效果適當(dāng)調(diào)整循環(huán)數(shù)。
4.電泳檢測(cè)。多重PCR反應(yīng)結(jié)束后,即可進(jìn)行常規(guī)的凝膠電泳檢測(cè)(對(duì)于植物等比較特殊的樣品,如有必要,可以離心取上清進(jìn)行電泳)。陽(yáng)性對(duì)照的檢測(cè)結(jié)果可以參考圖1。
常見(jiàn)問(wèn)題:
1.PCR產(chǎn)物非常少或沒(méi)有特異性條帶。
a.引物設(shè)計(jì)不佳是PCR過(guò)程中最常見(jiàn)的問(wèn)題。請(qǐng)選擇適當(dāng)?shù)囊镌O(shè)計(jì)軟件進(jìn)行引物設(shè)計(jì),注意引物的GC含量、二級(jí)結(jié)構(gòu)、二聚體、退火溫度、長(zhǎng)度、特異性等方面的問(wèn)題。在加入酶切位點(diǎn)等的引物中,一定要注意加入酶切位點(diǎn)等后整條引物的GC含量、二級(jí)結(jié)構(gòu)、二聚體、退火溫度、長(zhǎng)度、特異性等方面的問(wèn)題。在原有引物效果不佳的情況并且陽(yáng)性對(duì)照引物可以正常工作的情況下,可以考慮更換引物。
b.待擴(kuò)增片段GC含量偏高。向PCR體系中加入適合擴(kuò)增高GC含量DNA片段的D7303S PCR Enhancer (2X),并相應(yīng)地根據(jù)其要求或說(shuō)明調(diào)整PCR反應(yīng)參數(shù)的設(shè)置。
c.部分目的片段過(guò)長(zhǎng)。盡管 DNA Polymerase可以擴(kuò)增最長(zhǎng)達(dá)5kb的DNA片段,但在多重PCR時(shí),大多數(shù)時(shí)候更適合擴(kuò)增1.5kb以下的片段。過(guò)長(zhǎng)的目的片段不太適合在多重PCR時(shí)進(jìn)行擴(kuò)增。
d.引物的二級(jí)結(jié)構(gòu)、引物二聚體或引物偏短會(huì)導(dǎo)致退火效果不佳。此時(shí)可以采用Touch down等方法進(jìn)行退火,通常采用從65℃逐步緩慢降溫到55℃或50℃的方法,使退火更加充分。
e.退火溫度不佳,需要優(yōu)化。如果有溫度梯度PCR儀,則可以設(shè)置退火的溫度梯度,摸索退火的最佳溫度。如果沒(méi)有溫度梯度PCR儀,則可以通過(guò)多次PCR反應(yīng)摸索最佳的退火溫度。
f.延伸時(shí)間不足。可按照每1kb片段延伸2分鐘進(jìn)行設(shè)置,對(duì)于較難擴(kuò)增的片段可以設(shè)置為每1kb片段延伸3-4分鐘。
g.在不同PCR儀上進(jìn)行PCR反應(yīng),避免有時(shí)PCR儀出現(xiàn)問(wèn)題。
h.循環(huán)數(shù)不足,適當(dāng)延長(zhǎng)PCR的循環(huán)數(shù)。通常循環(huán)數(shù)最高不必超過(guò)40,常用的循環(huán)數(shù)范圍為30-40。
i.模板用量偏少,可以適當(dāng)加大模板用量。
j.對(duì)PCR引物進(jìn)行脫鹽甚至PAGE膠或HPLC純化。
k.使用高質(zhì)量的dNTP混合物。
l.適當(dāng)增加B DNA polymerase的用量。
m.當(dāng)產(chǎn)生較多非特異性條帶時(shí),可以適當(dāng)提高退火溫度。
n.注意設(shè)置本產(chǎn)品提供的Control template and primer mix作為陽(yáng)性對(duì)照,以確認(rèn)整個(gè)多重PCR體系可以正常工作。
o.確保沒(méi)有漏加任何PCR反應(yīng)的組分。
2.雜帶較多或條帶彌散。
a.退火溫度提高 2-5°C。
b.適當(dāng)檢測(cè)PCR的循環(huán)數(shù)。
c.適當(dāng)減少模板的用量。
d.在室溫配制PCR體系容易產(chǎn)生非特異性條帶。推薦在冰浴上配制PCR反應(yīng)體系。
e.適當(dāng)減少 DNA Polymerase的用量,加入適合擴(kuò)增高GC含量DNA片段的D7303S PCR Enhancer (2X)。
f.適當(dāng)縮短延伸時(shí)間。