植物基因型快速鑒定試劑盒,即BeyoPlant™ Rapid Plant Genotyping Assay Kit植物樣品直接PCR預混液(2X),提供了一種使用特別便捷的all-in-one的2倍濃度的檢測試劑,加入一小塊植物葉片等柔嫩的組織和適量的引物和水,就可以直接進行PCR擴增,后續直接電泳觀察結果就可以判斷植物的基因型了。本產品不僅可以用于植物的基因型鑒定,也可以用于其它適當用途的植物樣品的直接PCR檢測,可以輕松完成長度達到5kb的DNA片段的擴增。
本試劑盒提供了可專門用于植物樣品的2倍濃度的PCR預混液,并且PCR結束后可以直接上樣電泳無需添加上樣緩沖液。本產品含有耐葉綠素的PlantTaq™ DNA聚合酶,這是一種經過基因工程改造的非常高效的適用于植物樣品直接PCR檢測的耐熱DNA聚合酶。
對于植物葉片等柔嫩樣品可以直接PCR檢測,無須提取DNA。本產品對玉米、絲瓜、甜椒、豆角、黃豆、辣椒、黃瓜、茄子、番茄等植物樣品中的葉綠素、多糖、多酚等各種PCR抑制劑表現出超強的抗性,對于新鮮采集的、4℃保存或低溫凍存的這些植物的葉片、嫩種子等,都無需進行DNA提取純化,可以直接用于PCR擴增目的DNA。
所需樣品少,耐受能力高。本產品用于20μl的PCR擴增體系時,通常僅加入0.1-1mm直徑葉片即可順利完成PCR檢測。
本產品提供了一對陽性對照引物,便于確認PCR檢測效果。該對引物是多種植物的通用引物,可以擴增多數植物葉綠體中高度保守的IRB18基因的297bp DNA片段。
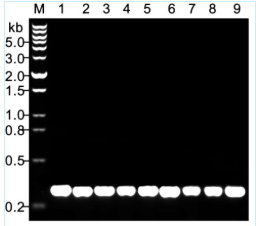
本產品用于植物葉片檢測的效果參考圖1。圖中可見,本產品對多種常見植物葉片都有很好的PCR擴增效果。

圖1. 植物基因型快速鑒定試劑盒檢測圖中所示不同植物葉片中目的基因的實測效果圖。使用BeyoPlant™植物基因型快速鑒定試劑盒中提供的Easy-Load™ Plant Direct PCR Master Mix (2X)和Control primer mix,在PCR體系中直接加入不同植物葉片,用于擴增IRB18基因的297bp DNA片段后的電泳效果圖。M, DNA marker (D0110 DNA Ladder (0.2-12 kb, 12 bands));1, 豆角(Cowpea);2, 黃豆(Soybean);3, 絲瓜(Sponge gourd);4, 甜椒(Capsicum);5, 玉米(Maize);6, 黃瓜(Cucumber);7, 辣椒(Pepper);8, 茄子(Eggplant);9, 番茄(Tomato)。
本產品擴增不同長度目的基因的效果參考圖2。圖中可見,本產品以番茄葉為模板可直接PCR擴增出長達5kb的DNA片段。

圖2. 植物基因型快速鑒定試劑盒直接以番茄葉片為模板擴增不同長度的目的基因的效果圖。M, DNA marker (D0110 DNA Ladder (0.2-12 kb, 12 bands)); 1, IRB18(297bp);2, actin(693bp);3, rbcL(1201bp);4, rpoC2(2069bp);5, rpoC2(3079bp);6, rpoC2(3942bp);7, rpoC2(5000bp)。
本產品擴增獲得的PCR產物帶有3'-dA overhangs的粘性末端,可直接用于和T載體連接進行TA克隆。
用途:植物葉片等比較柔嫩的組織樣品基因組DNA中目的基因的直接擴增、基因分型(如基因缺失等),以及基因敲除或轉基因植物基因型分析。
失活或抑制:酚氯仿抽提可以使Easy-Load™ Plant Direct PCR Master Mix (2X)中含有的PlantTaq™ DNA Polymerase失活。
本產品如果用于50微升的PCR反應體系,兩種包裝的本產品分別足夠用于40個和200個反應;如果用于20微升的PCR反應體系,兩種包裝的本產品分別足夠用于100個和500個反應。
包裝清單:
| 產品編號 | 產品名稱 | 包裝 |
| D7292S-1 | Easy-Load™ Plant Direct PCR Master Mix (2X) | 1ml |
| D7292S-2 | Control primer mix (10μM each) | 25μl |
| — | 說明書 | 1份 |
| 產品編號 | 產品名稱 | 包裝 |
| D7292M-1 | Easy-Load™ Plant Direct PCR Master Mix (2X) | 1ml×5 |
| D7292M-2 | Control primer mix (10μM each) | 125μl |
| — | 說明書 | 1份 |
保存條件:
-20℃保存。適當避免反復凍融。
注意事項:
由于PCR反應非常靈敏,在使用本產品時請注意避免微量待擴增DNA的污染,并盡量考慮設置不加模板的空白對照以確認是否有待擴增DNA的污染。
設置PCR反應體系時,20μl和50μl PCR體系中植物樣品的推薦用量分別為0.1-1mm和0.3-3mm直徑葉片或類似大小其它比較柔嫩的植物組織,可以直接添加到PCR體系中,無需進行任何額外處理。經測試本產品適用于柔嫩新鮮種子的直接PCR,但不適用于干硬種子的直接PCR。
PCR反應結束之后,酌情3000-5000g離心3-5min以沉淀植物組織碎片,便于吸取上清用于電泳分析等。
需自備Nuclease-Free Water。推薦選購ST876 BeyoPure™ Ultrapure Water (DNase/RNase-Free, Sterile)。
本產品僅限于專業人員的科學研究用,不得用于臨床診斷或治療,不得用于食品或藥品,不得存放于普通住宅內。
為了您的安全和健康,請穿實驗服并戴一次性手套操作。
使用說明:
1.PCR反應體系的設置:
a.融解并混勻試劑盒中的Easy-Load™ Plant Direct PCR Master Mix (2X)和Control primer mix (10μM each),置于冰浴上或冰盒內。
b.參考下表在冰浴上設置PCR反應體系:
| 試劑 | 20μl體系 | 50μl體系 | 終濃度 |
| Nuclease-Free Water | 9μl | 22.5μl | - |
| Easy-Load™ Plant Direct PCR Master Mix (2X) | 10μl | 25μl | 1X |
| 引物混合物(10μM each) | 1μl | 2.5μl | 0.5μM each |
| 植物樣品 | 0.1-1mm直徑 | 0.3-3mm直徑 | - |
| 總體積 | 20μl | 50μl | - |
注意:
(a)模板使用量:作為PCR模板的植物組織用量,對于20μl和50μl PCR反應體系,植物樣品的推薦用量分別為0.1-1mm和0.3-3mm直徑葉片或類似大小其它比較柔嫩的植物組織。如果模板為植物種子,盡量使用鮮嫩的植物種子。用干凈的解剖刀去掉種子外殼,剪下直徑約0.5-2mm的組織直接放入PCR管內;若種子太小,如番茄種子,可直接使用1-2粒完整的種子放入PCR管內進行擴增。50μl PCR體系,植物葉片或是種子直徑不宜超過3mm,太多模板易造成PCR抑制成分偏多,影響PCR效果。推薦取兩份植物組織樣品進行平行的PCR實驗,以降低取樣的不穩定性。為確保取樣的均一性,建議使用專用的打孔器或解剖刀進行取樣,并注意防止取樣過程中的交叉污染。每一次取樣,可以用2%的次氯酸鈉溶液清洗打孔器或解剖刀。對于高GC含量的PCR擴增,可以嘗試向PCR體系中加入終濃度1-10% (體積百分比)的DMSO。
(b)引物濃度:通常引物的終濃度為0.5μM時可獲得良好的檢測效果,也可以根據情況在0.1-1.0μM范圍內調整引物的終濃度。擴增效率不高的情況下,可提高引物的濃度;發生非特異性反應時,可降低引物濃度。
c.用移液器輕輕吹打混勻或輕微Vortex混勻,室溫離心數秒,使液體和待檢測植物組織積聚于管底。
d.如果所使用的PCR儀有熱蓋則省略本步驟。如果PCR儀沒有熱蓋,則在管內滴入一滴礦物油(ST275 Mineral oil (礦物油))。
e.把設置好的PCR反應體系置于PCR儀上,開始PCR反應。
2.PCR反應參數的設置可以參考如下表格:
| 步驟 | 循環數 | 溫度 | 時間 | 說明 |
| 1 | - | 94℃ | 5min | 起始變性 |
| 2 | 30-40 | 94℃ | 30sec | 變性 |
| 55℃ | 30sec | 退火 | ||
| 68℃ | 2min/kb | 延伸 | ||
| 3 | - | 68℃ | 10min | 最終延伸 |
| 4 | - | 4℃ | 長時間保持 | 臨時存放 |
注意:
a.起始變性(94℃,5min)可以使植物組織樣品裂解,釋放出可用于PCR擴增的基因組DNA。
b.需根據每次反應的模板、引物、PCR產物的長度和GC含量等適當優化PCR反應條件,包括溫度、時間和循環數等。
c.對于初次進行的PCR,為盡量確保可以擴增出預期的PCR產物,可以把循環數設置為35。
常見問題:
1.PCR產物非常少或沒有特異性條帶。
a.引物設計不佳是PCR過程中最常見的問題。請選擇適當的引物設計軟件進行引物設計,注意引物的GC含量、二級結構、二聚體、退火溫度、長度、特異性等方面的問題。在加入酶切位點等的引物中,一定要注意加入酶切位點等后整條引物的GC含量、二級結構、二聚體、退火溫度、長度、特異性等方面的問題。在原有引物效果不佳的情況并且陽性對照引物可以正常工作的情況下,可以考慮更換引物。
b.待擴增片段GC含量偏高。向PCR體系中嘗試加入適合擴增高GC含量DNA片段的試劑。
c.目的片段過長。盡管PlantTaq™ DNA Polymerase可以擴增最長達5kb的DNA片段,但大多數時候更適合擴增2-3kb以下的片段。對于過長的目的片段的擴增,需要適當優化引物和PCR反應參數。
d.引物的二級結構、引物二聚體或引物偏短會導致退火效果不佳。此時可以采用Touch down等方法進行退火,通常采用從65℃逐步緩慢降溫到55℃或50℃的方法,使退火更加充分。
e.退火溫度不佳,需要優化。如果有溫度梯度PCR儀,則可以設置退火的溫度梯度,摸索退火的最佳溫度。如果沒有溫度梯度PCR儀,則可以通過多次PCR反應摸索最佳的退火溫度。
f.延伸時間不足。可按照每1kb片段延伸2分鐘進行設置,對于較難擴增的片段可以設置為每1kb片段延伸3-4分鐘。
g.在不同PCR儀上進行PCR反應,避免有時PCR儀出現問題。
h.循環數不足,適當延長PCR的循環數。通常循環數最高不必超過40,常用的循環數范圍為30-40。
i.模板用量偏少,可以在耐血體積范圍內適當加大樣品用量,或采用巢式PCR (nested PCR)或二次PCR。巢式PCR即為在原先設計的PCR引物內側再設計一對PCR引物,然后對第一次PCR產物進行稀釋后再進行一次PCR擴增,這樣一方面可以起到擴增作用,同時也可以從第一次PCR產物中擴增出特異性條帶。二次PCR則為比較簡單地用原有引物對第一次PCR產物進行稀釋后再進行一次PCR擴增,可以起到擴增作用,但不能去除非特異性條帶。
j.對PCR引物進行脫鹽甚至PAGE膠或HPLC純化。
k.當產生較多非特異性條帶時,可以適當提高退火溫度。
l.注意設置適當的陽性對照和陰性對照通常會對于實驗結果的判斷有很大幫助。
2.雜帶較多或條帶彌散
a.退火溫度提高 2-5℃。
b.減少植物組織樣品的用量。
c.在室溫配制PCR體系容易產生非特異性條帶。推薦在冰浴上配制PCR反應體系。
d.如果模板的GC含量過高,需要考慮加入適合擴增高GC含量DNA片段的試劑。
e.適當縮短延伸時間。