Calcein/PI細胞活性與細胞毒性檢測試劑盒(Calcein/PI Cell Viability/Cytotoxicity Assay Kit,或Calcein/PI Live/Dead Viability/Cytotoxicity Assay Kit)是一種非常便捷的基于Calcein-AM (鈣黃綠素)和PI (碘化丙啶)雙熒光染色法檢測動物細胞死活的試劑盒。
本試劑盒使用便捷,熒光染色和檢測僅需約30分鐘。本試劑盒染色30分鐘后,就可進行后續的熒光顯微鏡拍照、流式分析或者熒光酶標儀定量等熒光檢測和分析。
本試劑盒的原理是兩種探針可分別檢測細胞內酯酶活性和細胞膜完整性,從而反映細胞活性與細胞毒性。其中Calcein AM染色活細胞,呈現綠色熒光;而碘化丙啶(Propidium Iodide, PI)染色死細胞,呈現紅色熒光。本試劑盒用于檢測動物細胞活性與細胞毒性效果參考圖1。
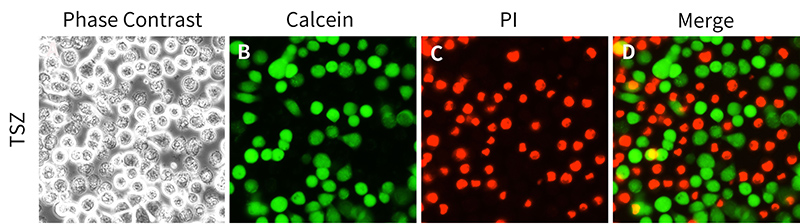
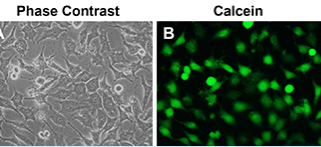
圖1. Calcein/PI細胞活性與細胞毒性檢測試劑盒用于L929細胞活性與細胞毒性檢測的效果圖。L929細胞(也稱L-929細胞)在明場視野下仔細觀察可以看到有明顯的壞死細胞(圖A);綠色熒光標記的即為Calcein染色的活細胞(圖B),紅色熒光標記的即為PI染色的死細胞(圖C);Calcein和PI雙染疊加(merge)后可以非常清晰地觀察到活細胞和死細胞的熒光染色差別(圖D)。在本實驗中,L929細胞經TSZ處理3小時。TSZ為TNFα、SM-164和Z-VAD-FMK組成的細胞程序性壞死誘導試劑(C1058)。實測數據會因實驗條件、檢測儀器等的不同而存在差異,圖中數據僅供參考。
Calcein AM (Calcein Acetoxymethyl Ester,中文名稱為鈣黃綠素AM或鈣黃綠素乙酰氧基甲酯),是一種可以對活細胞進行熒光染色的細胞染色試劑,Calcein AM是在Calcein (鈣黃綠素)的基礎上增加了乙酰氧基甲酯(AM)基團,加強了疏水性,因此能夠很容易穿透細胞膜。Calcein AM本身并沒有熒光,進入細胞后被活細胞中內源性酯酶水解生成具有強負電荷的不能通透細胞膜的極性分子鈣黃綠素(Calcein),從而被滯留在細胞內,而Calcein可發出強綠色熒光。由于死細胞缺乏酯酶或酯酶活性很低,Calcein AM進入細胞后含有酯酶的活細胞可以產生Calcein,而死細胞不能或很少能產生Calcein,因此僅活細胞會被染色為強綠色熒光,死細胞不能被染色或者染色非常弱。核酸紅色熒光染料碘化丙啶(Propidium Iodide, PI)由于不能穿透活細胞的細胞膜,而只能染色細胞膜完整性被破壞的死細胞。因此,Calcein AM與碘化丙啶聯合使用,對活細胞和死細胞同時進行雙重熒光染色,就能用于細胞活性與細胞毒性的檢測。
Calcein AM水解產物Calcein的最大激發光波長為494nm,最大發射光波長為517nm;PI-DNA復合物的最大激發光波長為535nm,最大發射光波長為617nm。Calcein和PI-DNA的激發光譜和發射光譜參考圖2。
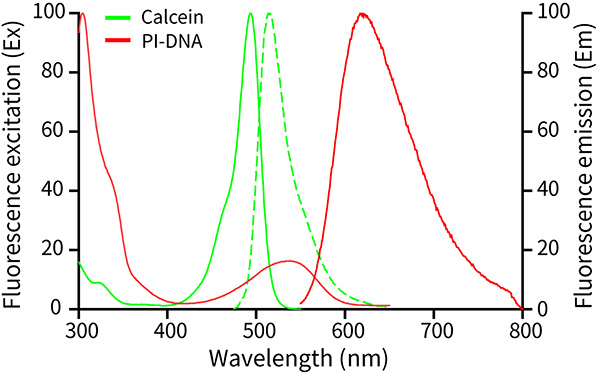
圖2. Calcein和PI-DNA的激發光譜和發射光譜。
本試劑盒可以用于大多數的哺乳動物細胞的檢測。有報道稱Calcein AM也可以用于一些植物細胞如擬南芥(Arabidopsis)的根邊緣樣細胞(root border-like cells)、一些酵母如Pichia anomala和Saccharomyces cerevisiae和一些寄生蟲如Leishmania。由于一些寄生蟲細胞膜組分比較特殊的原因,Calcein AM不能進入相應的活細胞,但可以進入凋亡早期的寄生蟲細胞,從而與PI聯用可以用于檢測凋亡早期的寄生蟲細胞。由于真菌和細菌有細胞壁,會阻礙Calcein進入細胞,因此Calcein AM不適合用于真菌和細菌。本試劑盒與類似用途的臺盼藍染色液相比,更快捷且靈敏度更高。
本試劑盒提供的Calcein AM和PI為1000X溶液,使用非常便捷。并且這兩種溶液都經過優化,對大多數細胞都適用,但為得到比較理想的結果,也可根據細胞類型和實驗實際情況對Calcein AM或PI在500-2000稀釋倍數之間進行適當調整。同時,本試劑盒提供了檢測緩沖液,該緩沖液可在一段時間內維持細胞的正常狀態,并給細胞提供一定的營養,效果比PBS或HBSS更好。
對于96孔板,按推薦稀釋倍數配制相關檢測試劑,且每孔使用100μl,此時本試劑盒的小包裝、中包裝和大包裝分別可以檢測100次、500次和2500次。
包裝清單:
| 產品編號 | 產品名稱 | 包裝 |
| C2015S-1 | Calcein AM (1000X) | 12μl |
| C2015S-2 | PI (1000X) | 12μl |
| C2015S-3 | 檢測緩沖液 | 12ml |
| — | 說明書 | 1份 |
| 產品編號 | 產品名稱 | 包裝 |
| C2015M-1 | Calcein AM (1000X) | 55μl |
| C2015M-2 | PI (1000X) | 55μl |
| C2015M-3 | 檢測緩沖液 | 55ml |
| — | 說明書 | 1份 |
| 產品編號 | 產品名稱 | 包裝 |
| C2015L-1 | Calcein AM (1000X) | 260μl |
| C2015L-2 | PI (1000X) | 260μl |
| C2015L-3 | 檢測緩沖液 | 260ml |
| — | 說明書 | 1份 |
保存條件:
-20℃保存,一年有效。Calcein AM (1000X)和PI (1000X)需要避光保存。
注意事項:
熒光染料均存在淬滅問題,請盡量注意避光,以減緩熒光淬滅。
Calcein AM (1000X)在潮濕環境中容易分解,首次使用時建議適當分裝并-20℃密封保存。
由于Calcein AM在水溶液中不穩定,Calcein AM檢測工作液須現配現用,不能配制后凍存。
培養液中的血清和酚紅對Calcein AM的染色可能有一定的影響,使熒光背景增強,建議在加入Calcein AM檢測工作液前適當洗滌細胞。
本產品僅限于專業人員的科學研究用,不得用于臨床診斷或治療,不得用于食品或藥品,不得存放于普通住宅內。
為了您的安全和健康,請穿實驗服并戴一次性手套操作。
使用說明:
1.Calcein AM/PI檢測工作液的配制:
按照96孔板每孔100μl Calcein AM/PI檢測工作液的體系,參考下表配制適量的Calcein AM/PI檢測工作液,并充分混勻。
| 10個樣品 | 100個樣品 | 1000個樣品 | |
| Calcein AM (1000X) | 1μl | 10μl | 100μl |
| PI (1000X) | 1μl | 10μl | 100μl |
| 檢測緩沖液 | 1ml | 10ml | 100ml |
| Calcein AM/PI檢測工作液 | 1ml | 10ml | 100ml |
注1:為得到比較理想的結果,可根據細胞類型和實際染色效果對Calcein AM (1000X)和PI (1000X)在500-2000稀釋倍數之間進行適當調整。
注2:配制好的Calcein AM/PI檢測工作液必須一次使用完畢,不能凍存。
注3:也可以用其它合適的溶液,如無血清培養液、HBSS (C0218)或PBS (C0221A/C0221D)稀釋Calcein AM (1000X)。本試劑盒配套提供的檢測緩沖液可在一段時間內維持細胞的正常狀態,并給細胞提供一定的營養,效果通常比PBS或HBSS更好。
2.熒光顯微鏡檢測:
a.接種培養。將細胞接種于96孔板等多孔板、細胞培養皿中或者細胞爬片上,按實驗設計對細胞進行一定處理。
b.洗滌(選做)。對于貼壁細胞,吸除培養液,用PBS洗滌細胞1遍;對于懸浮細胞,250-1000×g室溫離心5min,吸除上清,用PBS洗滌1遍。酚紅或血清對于本試劑盒的檢測有一定的干擾,吸除培養液和PBS時最好使用真空泵。在能充分吸凈殘留液體的情況下,可以不使用PBS洗滌。
c.染色。加入適當體積的Calcein AM/PI檢測工作液。通常96孔板每孔加入100μl,24孔板每孔加入250μl,12孔板每孔加入500μl,6孔板每孔加入1ml。37℃避光孵育30min。不同的細胞最佳孵育時間有所不同,以30min作為初始孵育時間,后續可以根據實際染色效果對染色時間進行適當調整和優化,以得到更加理想的染色效果。
d.檢測。孵育結束后,在熒光顯微鏡下觀察染色效果(Calcein AM為綠色熒光,Ex/Em=494/517nm;PI為紅色熒光,Ex/Em=535/617nm)。對于貼壁細胞L929,本產品的熒光染色效果參考圖1。如有需要,也可進一步進行其它熒光的復染,例如使用Hoechst 33342活細胞染色液(C1027/C1028/C1029)染色細胞核等。注意整個過程均需注意避光操作。
3.流式細胞儀檢測:
a.細胞準備。貼壁細胞胰酶消化后用培養液重懸,并用PBS洗滌一次;懸浮細胞250-1000×g室溫離心5min,棄上清,用PBS洗滌一次。每個樣品推薦的細胞用量為106個細胞。
b.染色。對于上一步驟的106個細胞的沉淀,加入1ml Calcein AM/PI檢測工作液,重懸為單細胞懸液。37℃避光孵育30min。注:需要準備好僅含緩沖液的細胞樣品用作流式細胞儀檢測時的陰性對照,該緩沖液與配制Calcein AM/PI檢測工作液的緩沖液宜保持一致。同時準備兩管額外的細胞樣品,每管只加入一種染料(Calcein AM或PI),用于流式單染的補償調節。
c.檢測。孵育完成后,可以直接進行流式細胞儀檢測,也可以250-1000×g室溫離心5min沉淀細胞,吸凈液體后每個樣品加入0.5ml緩沖液重懸細胞后用流式細胞儀檢測(Calcein AM為綠色熒光,Ex/Em=494/517nm;PI為紅色熒光,Ex/Em=535/617nm)。如有需要,也可進行進一步染色,例如使用Hoechst 33342活細胞染色液(C1027/C1028/C1029)染色細胞核等。注意整個過程均需注意避光操作。染色后,將樣品置于冰上,并盡量在1小時內進行流式細胞儀檢測和分析。
注1:使用僅含檢測緩沖液的并且未經染色的細胞樣品用于流式細胞儀的陰性對照設置。
注2:細胞圈門(gate)時,注意不要圈入細胞碎片,并使用Calcein AM或PI單染的細胞進行調節補償。雙染細胞流式檢測應獲得兩個相對獨立的細胞群:綠色熒光的活細胞群和紅色熒光的死細胞群。
注3:由于流式檢測比較靈敏,使用的熒光探針濃度可能要比熒光顯微鏡檢測時要低,此時可根據細胞類型和實際染色情況對Calcein AM或PI的稀釋倍數進行適當調整。
4.熒光酶標儀檢測細胞死活的變化:
a.接種培養。將細胞接種于96孔板黑色多孔板中,如BeyoGold™全黑96孔細胞培養板(FCP966),每孔的細胞數需要控制在100-10,000個,通常宜在2000-5000個范圍內。按實驗設計對細胞進行一定處理。
b.洗滌(選做)。對于貼壁細胞,吸除培養液,用PBS洗滌細胞1遍;對于懸浮細胞,250-1000×g室溫離心5min,吸除上清,用PBS洗滌1遍。酚紅或血清對于本試劑盒的檢測有一定的干擾,吸除培養液和PBS時最好使用真空泵。在能充分吸凈殘留液體的情況下,可以不使用PBS洗滌。
c.染色。加入適當體積的Calcein AM/PI檢測工作液,通常96孔板每孔加入100μl。37℃避光孵育30min。不同的細胞最佳孵育時間有所不同,以30min作為初始孵育時間,后續可以根據實際染色效果對染色時間進行適當調整和優化,以得到更加理想的染色效果。
d.檢測。孵育結束后,用熒光酶標儀檢測(Calcein AM為綠色熒光,Ex/Em=494/517nm;PI為紅色熒光,Ex/Em=535/617nm)。通過對比對照組與處理組的RFU (Relative fluorescence values),可以得出死細胞與活細胞數量的變化。
5.熒光酶標儀檢測細胞死活的比例:本方法通過設置對照,可計算出死細胞與活細胞的比例。
a.細胞培養和處理同前。
b.除配制Calcein AM/PI檢測工作液外,還需要配制單獨的Calcein AM檢測工作液和PI檢測工作液用于對照的檢測。配制方法和稀釋倍數與Calcein AM/PI檢測工作液的配制一致。
c.檢測樣品組和對照組設置:
對于下面組別的細胞或無細胞組,需要保持細胞數量、檢測工作液濃度、孵育時間和孵育溫度的完全一致。
| 編號 | 組別 | 檢測工作液 | 激發波長 | 發射波長 | 結果命名 |
| (1) | 樣品組 | Calcein AM/PI | 494nm | 517nm | F(517)sam |
| (2) | 樣品組 | Calcein AM/PI | 535nm | 617nm | F(617)sam |
| (3) | 活細胞組 | PI | 494nm | 517nm | F(517)min |
| (4) | 活細胞組 | Calcein AM | 494nm | 517nm | F(517)max |
| (5) | 死細胞組 | PI | 535nm | 617nm | F(617)max |
| (6) | 死細胞組 | Calcein AM | 535nm | 617nm | F(617)min |
| (7) | 無細胞組 | Calcein AM/PI | 494nm | 517nm | F(517)0 |
| (8) | 無細胞組 | Calcein AM/PI | 535nm | 617nm | F(617)0 |
活細胞組為沒有加入藥物處理的細胞;死細胞組可用0.1-0.5%洋地黃皂苷(ST1272)或0.1%皂素處理細胞10分鐘,或70%乙醇孵育細胞30分鐘即可得到死細胞。
d.染色和檢測步驟同前。
e.根據檢測數據計算死細胞與活細胞的比例:
% Live Cells =F(517)sam-F(517)min
F(517)max-F(517)min×100%
% Dead Cells =F(617)sam-F(617)min
F(617)max-F(617)min×100%
注1:其中所有的F(517)和F(617)都減去相應的F(517)0和F(617)0。
注2:如果需要確定活細胞與死細胞的具體數量,可制作不同數量活細胞與死細胞在517nm和617nm處的熒光光譜標準曲線。該標準曲線呈線性關系,因此通過標準曲線和樣品中兩個染料的熒光強度可計算出活細胞與死細胞的數量。