EdU-647細胞增殖檢測試劑盒( EdU Cell Proliferation Kit with Alexa Fluor 647),是一種基于DNA合成過程中胸腺嘧啶脫氧核苷(thymidine)類似物EdU(5-ethynyl-2' -deoxyuridine)的摻入,并通過隨后的點擊反應(Clickreaction)使EdU被Alexa Fluor 647所標記,從而實現簡單、快速、高靈敏地檢測細胞增殖的試劑盒。
本試劑盒可以檢測到細胞或組織樣品中單個的增殖細胞,同時也可以對細胞或組織樣品總體的細胞增殖情況進行定量檢測。本試劑盒可以檢測培養的細胞或組織樣品,也可以檢測組織切片。
經本試劑盒處理后,增殖的細胞在激光共聚焦顯微鏡下呈現較強的遠紅外熒光。通常該熒光探針被激發后,肉眼不能觀察到激發出來的長波長熒光,但可以被很多成像系統例如激光共聚焦顯微鏡等或有相應激發和發射檢測模塊的流式細胞儀或熒光酶標儀所檢測到,也可以用于高內涵篩選(High-Content Screening, HCS)。流式細胞儀或熒光酶標儀檢測僅適用于細胞樣品,不適用于組織切片。
細胞增殖能力的檢測是評估細胞活性、基因毒性和抗腫瘤藥物效果等的基本方法。公認的最精確的檢測細胞增殖的方法是直接檢測細胞中DNA的合成。最初廣泛使用的通過檢測DNA合成來檢測細胞增殖的方法是放射性標記核苷摻入法,如氚標記胸腺嘧啶脫氧核苷([3H]thymidine)摻入法。但該方法由于有放射性污染并且很難實現單細胞檢測而受到很大的限制,隨后逐漸被基于抗體檢測的BrdU(bromo-deoxyuridine)法所替代。BrdU法步驟繁多,且需要使用BrdU抗體,影響因素較多,穩定性比較差。并且由于BrdU法需要使用抗體,有時會和其它目的蛋白基于抗體的檢測相互產生干擾。EdU法基于EdU摻入和后續的點擊反應,無需使用抗體、操作便捷、檢測靈敏度高,是一種在BrdU法基礎上升級換代的新方法,將會逐步取代BrdU法。
MTT法(C0009)、WST-1法(C0035、C0036)、CCK-8法(C0037、C0038、C0039、C0040、C0041、C0042、C0043、C0046)和CellTiter-Lumi™化學發光法(C0065、C0068)都是基于細胞活性的細胞增殖檢測方法,能檢測到細胞的總體增殖效果,但無法檢測到單個的增殖細胞。這幾種方法盡管都不是檢測DNA合成的,但被廣泛用于替代[3H]thymidine摻入法。CFDA SE法(C0051、C1031)基于細胞熒光示蹤的原理能檢測到單個的增殖細胞,但由于每增殖一次熒光減弱一半,在熒光顯微鏡下較難區分熒光減弱一半的細胞,檢測靈敏度不是很高,通常僅適用于流式細胞儀檢測。在進行科學研究時,上述這些基于細胞活性或CFDA SE的方法可以作為EdU法的補充性檢測方法。(C0051、C1031)基于細胞熒光示蹤的原理能檢測到單個的增殖細胞,但由于每增殖一次熒光減弱一半,在熒光顯微鏡下較難區分熒光減弱一半的細胞,檢測靈敏度不是很高,通常僅適用于流式細胞儀檢測。在進行科學研究時,上述這些基于細胞活性或CFDA SE的方法可以作為EdU法的補充性檢測方法。
EdU(5-ethynyl-2' -deoxyuridine),中文名為5-乙炔基-2' -脫氧尿苷,是一種新型胸苷(胸腺嘧啶脫氧核苷,thymidine)類似物,EdU可以在DNA合成過程中替代胸苷摻入到新合成的DNA中。另一方面,EdU上的乙炔基能與熒光標記的小分子疊氮化物探針(如Azide Alexa Fluor 488、Azide Alexa Fluor 555、Azide Alexa Fluor 594、Azide Alexa Fluor 647等)通過一價銅離子的催化發生共價反應,形成穩定的三唑環,該反應非常迅速,被稱作點擊反應(Click reaction),其反應原理參見圖1。通過點擊反應,新合成的DNA會被相應的熒光探針所標記,從而可以使用適當的熒光檢測設備檢測到增殖的細胞。
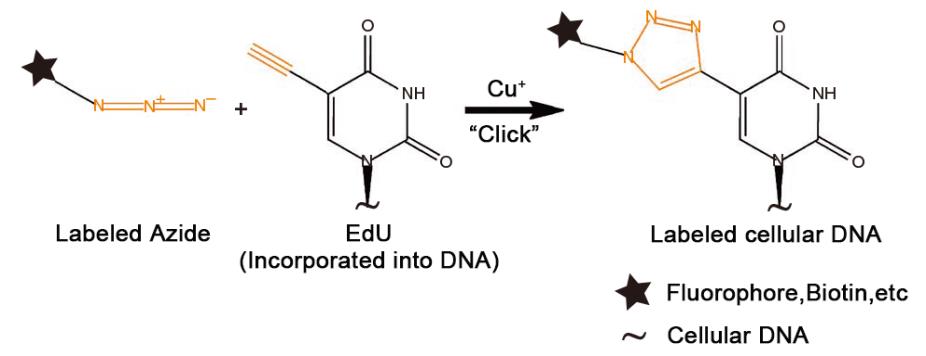
圖1. EdU檢測法中的點擊反應(Click reaction)原理圖。熒光探針等標記的疊氮化物(Labeled Azide)與摻入到細胞DNA中的EdU,在銅離子的催化發生共價反應,形成穩定的三唑環,最終使細胞DNA標記上熒光探針或其它探針。
本試劑盒反應簡單、檢測靈敏度高。本試劑盒基于簡單高效的點擊反應,無需DNA變性,只需少量的小分子疊氮化物探針即可非常有效地標記出摻入的EdU,并且可以檢測到單個細胞的增殖情況。
本試劑盒使用便捷、兼容性好。本試劑盒只需常用的多聚甲醛固定和Triton X-100穿透,就可以使疊氮化物探針有效進入細胞并發生點擊反應,不會影響細胞形態,不會影響基于抗體的免疫熒光和免疫組化檢測,也不會影響DNA的熒光染色(如PI染色檢測細胞周期、DAPI或Hoechst染料檢測細胞核)。而BrdU法為了使大分子的BrdU抗體進入細胞并與DNA上的BrdU結合,需要對雙鏈DNA進行變性處理(如酸變性、熱變性或者DNase消化等),這種變性可能會影響細胞形態,影響后續的免疫熒光和免疫組化檢測、DNA的熒光染色等。BrdU法和 EdU法檢測原理的比較參見圖2。
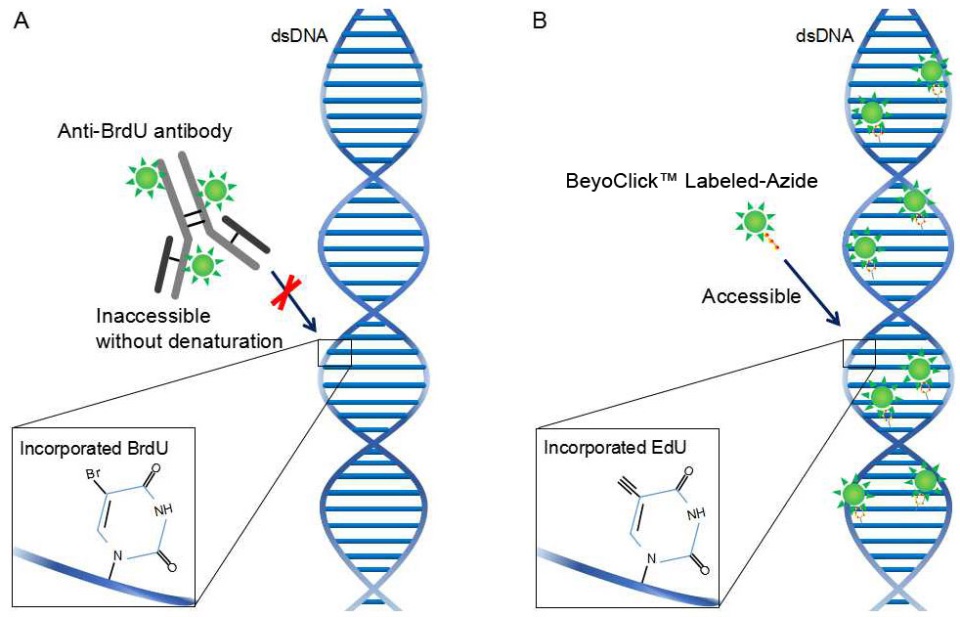
圖2. BrdU法和 EdU法檢測原理的比較。A. BrdU法需使用大分子的BrdU抗體,由于空間位阻,雙鏈DNA須變性后才能使BrdU抗體與BrdU結合。B. EdU法使用小分子標記的疊氮化物(Azide),無需DNA變性,操作更便捷,兼容性好,檢測結果更加穩定可靠。
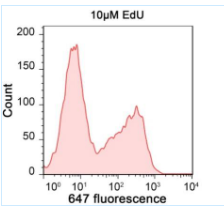
本試劑盒檢測快速。相對于至少需要4小時的BrdU法,本試劑盒采用的 EdU法檢測新合成的DNA只需1.5-2小時, 時間上大大縮短。本試劑盒同時提供了染色細胞核的Hoechst 33342,以方便染色觀察所有的細胞核。可以使用熒光顯微鏡或流式細胞儀等進行定性和定量檢測。Jurkat細胞用本試劑盒和流式細胞儀檢測細胞增殖的效果參見圖3。
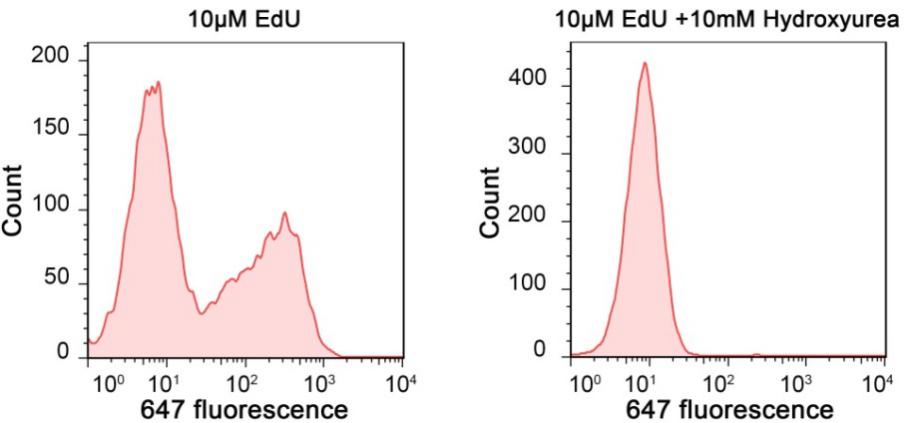
圖3. Jurkat細胞用本試劑盒標記后用流式細胞儀檢測細胞增殖的效果圖。Jurkat細胞只用EdU標記(左圖),或在標記的同時用10mM的DNA合成抑制劑羥基脲(Hydroxyurea)處理(右圖),2小時后用本試劑盒進行點擊反應,然后用流式細胞儀進行檢測。從圖中可以看出,僅EdU標記的細胞有較高比例的遠紅外熒光(647 fluorescence)陽性細胞,呈現遠紅外熒光陰性(弱染色)和陽性(強染色)的兩個峰(左圖),分別對應于未增殖細胞和增殖細胞。經過羥基脲處理的細胞,遠紅外熒光陽性的細胞幾乎完全消失(右圖),僅剩下一個遠紅外熒光陰性的峰(右圖)。該檢測結果說明DNA合成被抑制后,EdU的摻入也被抑制。實測數據可能會因細胞類型、細胞增殖情況、檢測儀器等的不同而存在差異,圖中數據僅供參考。
各種細胞增殖和細胞毒性檢測試劑盒的比較和選擇,請參考 http://www.beyotime.com/cell-proliferation.htm。
本試劑盒小包裝C0081S如果用于培養的細胞(6孔板)的檢測,可以檢測50個樣品,每個樣品的反應體系為500μl的Click反應液;如果用于96孔板檢測,可以檢測500個樣品,每個樣品的檢測體系為50μl的Click反應液;如果用于12孔、24孔、48孔或384孔板樣品的檢測,分別可以檢測125、250、350和1250個樣品,每個樣品推薦的Click反應液用量為200μl、100μl、70μl和20μl。小包裝如果用于流式細胞儀檢測,可以檢測50個樣品,每個細胞樣品的細胞數量宜為10-100萬,每個樣品的反應體系為500μl的Click反應液。小包裝如果用于冰凍或石蠟切片的檢測,可以檢測125-250個樣品, 每個樣品的反應體系為100-200μl的Click反應液。大包裝C0081L可檢測樣品的數量為小包裝C0081S的4倍。
包裝清單:
| 產品編號 | 產品名稱 | 包裝 |
| C0081S-1 | EdU (10mM) | 200μl |
| C0081S-2 | Azide 647 | 55μl |
| C0081S-3 | Click Reaction Buffer | 30ml |
| C0081S-4 | CuSO4 | 1.1ml |
| C0081S-5 | Click Additive | 2管 |
| C0081S-6 | Hoechst 33342 (1000X) | 50μl |
| — | 說明書 | 1份 |
保存條件:
-20℃保存,一年有效。Azide 647和Hoechst 33342須避光保存。
注意事項:
Click Additive配制成溶液后請注意適當分裝。如果溶解后有白色物質析出,請上下顛倒多次,待全部溶解后使用。如果該溶液顏色變成棕色,說明該組分的有效成分已失效,請棄用。
2.檢測體系的準備
a.如下以6孔板或常規切片檢測體系為例,如果使用12孔板、96孔板或384孔板等孔板,檢測體系可以相應按比例縮小。
b.如果檢測的是懸浮細胞,請按常規的懸浮細胞的操作方式進行。例如和貼壁細胞相比,相關步驟需要增加離心步驟等,如1000×g室溫離心5min。
3.培養細胞的EdU標記及固定、洗滌和通透
a.在6孔板中(如有必要可以加入蓋玻片)培養適當數量的細胞。細胞培養過夜并且恢復到正常狀態后,進行所需的藥物處理或者其它刺激處理等。
b.配制2X的EdU工作液:由于EdU工作液是與培養液等體積加入到孔板中,所以需要配制成2X的工作液。推薦的EdU終濃度為10μM (1X),用細胞培養液1:500稀釋EdU (10mM)即可得到2X的EdU工作液(20μM)。
注意:對于A549、HeLa和NIH/3T3等貼壁細胞,推薦EdU的使用終濃度為10μM。但細胞類型、培養液種類、細胞密度、細胞增殖速度等多方面的因素會影響EdU摻入到細胞中的量,因此初次使用時建議對EdU的使用濃度進行一定的摸索。如果之前使用過BrdU進行實驗,則可以參考BrdU的終濃度作為EdU的終濃度。
c.將37℃預熱的2X的EdU工作液(20μM),等體積加入6孔板中,使6孔板中的EdU終濃度變為1X。例如設計終濃度為10μM,原先6孔板中的培養基為1ml,則將1ml 2X的EdU工作液(20μM)加入到孔板中。如果培養基體積過大,可以先吸除適量的培養液,再加入等體積的2X的EdU工作液;或者可以減少工作液的體積并增加EdU的濃度,使最終培養液中的EdU濃度為10μM,例如2ml培養液中加入220微升0.1mM EdU。更換所有的培養液可能會對細胞的增殖有影響,因此不建議替換所有的培養液。
d.繼續孵育細胞2小時。該孵育時間的長短取決于細胞生長速率,通常宜繼續孵育細胞周期10%左右的時間。對于常見的哺乳動物細胞如HeLa、3T3、HEK293等,細胞周期大約在18-25小時,孵育時間宜在2小時左右。人胚胎細胞的細胞周期約30分鐘,推薦的孵育時間為5分鐘;酵母細胞的細胞周期約3小時,推薦的孵育時間為20分鐘,增殖的神經細胞其細胞周期約5天,推薦的孵育時間為1天。孵育時間小于45分鐘時,建議提高EdU的濃度;孵育時間大于20小時時,建議適當降低EdU的濃度。
e.EdU標記細胞完成后,去除培養液,并加入1ml固定液(可以使用免疫染色固定液P0098,或4%的多聚甲醛P0099),室溫固定15分鐘。注:對于流式細胞儀檢測,貼壁細胞胰酶消化后用培養液重懸后再固定。
f.去除固定液,每孔用1ml洗滌液洗滌細胞3次,每次3-5分鐘。
g.去除洗滌液,每孔用1ml通透液(可以使用免疫染色強力通透液P0097,免疫染色洗滌液P0106,或含0.3% Triton X-100的PBS),室溫孵育10-15分鐘。
h.去除通透液,每孔用1ml洗滌液洗滌細胞1-2次,每次3-5分鐘。
i.轉步驟5。
4.動物體內EdU的標記及切片樣品的處理
EdU可以通過注射或進食等適當方式進行動物的體內標記。如下以小鼠為例,其它動物體內EdU的標記請參考相關文獻。
a.對于小鼠,可以按照10-200mg/kg的用量,把EdU用PBS配制成一定濃度,腹腔注射、特定組織或器官局部注射或者加入飲用水中。具體用量跟所用動物的種類、體重和使用方式有關,可以參考相關文獻,因此初次使用時建議對EdU的使用濃度進行一定的摸索,或者直接使用50mg/kg的濃度進行測試。如果之前使用過BrdU進行實驗,則可以參考BrdU的終濃度作為EdU的終濃度。EdU可以單獨購買ST067。
b.4小時后或根據特定實驗確定的適當時間后,快速處死小鼠,取出所需的組織,按照常規步驟制作冰凍切片或石蠟切片。EdU標記的時間也可以參考相關文獻自行調整。
c.對于冰凍切片:
(a)加入適量固定液(可以使用免疫染色固定液P0098,或4%的多聚甲醛P0099),室溫固定15分鐘。
(b)去除固定液,用適量洗滌液洗滌3次,每次3-5分鐘。
(c)去除洗滌液,用適量通透液(可以使用免疫染色強力通透液P0097,免疫染色洗滌液P0106,或含0.3% Triton X-100的PBS),室溫孵育10-15分鐘。
(d)去除通透液,用適量洗滌液洗滌1-2次,每次3-5分鐘。
(e)抗原修復(選做):如果同時需要進行目的蛋白的免疫熒光染色,并有必要進行抗原修復,可以使用適當的抗原修復液,例如P0090冰凍切片快速抗原修復液(5X),或者自行配制的適當的抗原修復液進行抗原修復處理。
(f)轉步驟5。
d.對于石蠟切片:
(a)脫蠟:二甲苯中脫蠟5-10分鐘。換用新鮮的二甲苯,再脫蠟5-10分鐘。無水乙醇5分鐘,換新的無水乙醇3分鐘。95%乙醇3分鐘。85%乙醇3分鐘。75%乙醇3分鐘。50%乙醇3分鐘。PBS 5分鐘。
(b)抗原修復(選做):如果同時需要進行目的蛋白的免疫組化染色,可以使用適當的抗原修復液,例如P0081檸檬酸鈉抗原修復液(50X)、P0083改進型檸檬酸鈉抗原修復液(50X)、P0085 EDTA抗原修復液(50X)、P0086檸檬酸鈉-EDTA抗原修復液(40X)、P0088通用型強力抗原修復液(10X)、P0092漂片抗原修復液(10X),或者自行配制適當的抗原修復液進行抗原修復處理。
特別注意:如果使用蛋白酶K或胰酶進行抗原修復,必須反復洗滌干凈,否則殘留的酶會嚴重干擾后續標記反應。
(c)轉步驟5。
5.EdU檢測
注意:本步驟六孔板中每孔的反應體系為500μl的反應混合物。對于12、24、48、96和384孔板,每孔的反應的體系分別為200μl、100μl、70μl、50μl和20μl的反應混合物。對于較小的孔,單位培養面積的液體用量已經適當增加,以有效避免液體蒸發可能帶來的負面影響。對于切片,可以根據切片大小,每個切片使用100-200μl的反應混合物。如下以六孔板中的細胞樣品為例說明具體的操作方法,對于其它孔板或切片,僅每步溶液的用量按比例調整即可,其余方法相同。
a.配制Click Additive Solution:對于C0078S,用1.3ml去離子水溶解一管Click Additive,混勻至全部溶解,即為Click Additive Solution;對于C0078L,加入10.4ml去離子水溶解試劑盒中提供的一瓶Click Additive,混勻至全部溶解,即為Click Additive Solution。配制后可以適當分裝,并-20℃保存。
b.參考下表配制Click反應液。注意:請嚴格按照下表中組分順序和體積配制Click反應液,否則點擊反應可能無法有效進行;同時,Click反應液須在配制后15分鐘內使用。
| 組分 | 6孔板樣品數 | ||||||
| 1 | 2 | 4 | 5 | 10 | 25 | 50 | |
| Click Reaction Buffer | 430μl | 860μl | 1.72ml | 2.15ml | 4.3ml | 10.75ml | 21.5ml |
| CuSO4 | 20μl | 40μl | 80μl | 100μl | 200μl | 500μl | 1ml |
| Azide 647 | 1μl | 2μl | 4μl | 5μl | 10μl | 25μl | 50μl |
| Click Additive Solution | 50μl | 100μl | 200μl | 250μl | 500μl | 1.25ml | 2.5ml |
| 總體積 | 500μl | 1ml | 2ml | 2.5ml | 5ml | 12.5ml | 25ml |
c.去除上一步驟中的洗滌液。
d.每孔加入0.5ml Click反應液,輕輕搖晃培養板以確保反應混合物可以均勻覆蓋樣品。
e.室溫避光孵育30分鐘。
f.吸除Click反應液,用洗滌液洗滌3次,每次3-5分鐘。
g.如果需要對細胞核進行染色,可以參照步驟6進行。如無其它的特殊需要,即可在可以檢測遠紅外熒光的熒光顯微鏡下觀察,或者使用相應的流式細胞儀、多功能酶標儀進行熒光檢測,或者用高內涵篩選儀器(一般高內涵篩選需要使用染料對細胞核進行染色)進行檢測。Azide 647的最大激發波長是650nm,最大發射波長是670nm。
6.細胞核染色
為了檢測細胞增殖的比例,可以考慮使用Hoechst 33342進行細胞核染色。一般高內涵篩選儀器也需要對細胞核進行染色。
a.1X Hoechst 33342溶液的配制:按1:1000比例用PBS稀釋Hoechst 33342 (1000X)。
b.接上述步驟5g,吸除洗滌液后,每孔加1X Hoechst 33342溶液1ml,室溫避光孵育10分鐘。
c.吸除1X Hoechst 33342溶液。
d.用洗滌液洗滌3次,每次3-5分鐘。
e.隨后即可進行熒光檢測。Hoechst 33342為藍色熒光,最大激發波長為346nm,最大發射波長為460nm。
7.流式細胞儀檢測
對于經步驟5或6獲得的細胞懸液樣品進行流式檢測。如果使用傳統的流體動力學聚焦的流式細胞儀來測量總DNA含量,請在檢測過程中使用低流速,實驗中的每個樣品應使用相同的收集速率和細胞濃度。EdU標記產生的熒光信號一般使用對數刻度的橫坐標(如圖3中的橫坐標)。Azide 647的最大激發波長是650nm,最大發射波長是670nm。
注1:建議使用未經EdU標記的細胞樣品作為流式細胞儀檢測的陰性對照,并選擇合適的電壓。
注2:由于流式細胞儀檢測比較靈敏,可根據細胞類型和實際染色情況對Azide 647的使用量進行適當調整。