快速銀染試劑盒(Fast Silver Stain Kit)是一種快速簡單、可用于SDS-PAGE或非變性PAGE等蛋白銀染的試劑盒。
本試劑盒也可以用于2D凝膠的銀染,并且染色后和后續的質譜檢測兼容。
本試劑盒只需一小時左右即可觀察到蛋白條帶,90分鐘內可以完成2塊凝膠的銀染。
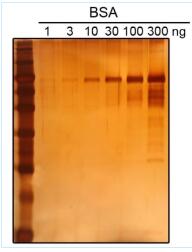
對于BSA蛋白,檢測靈敏度可以達到0.3ng蛋白。(參考圖1)
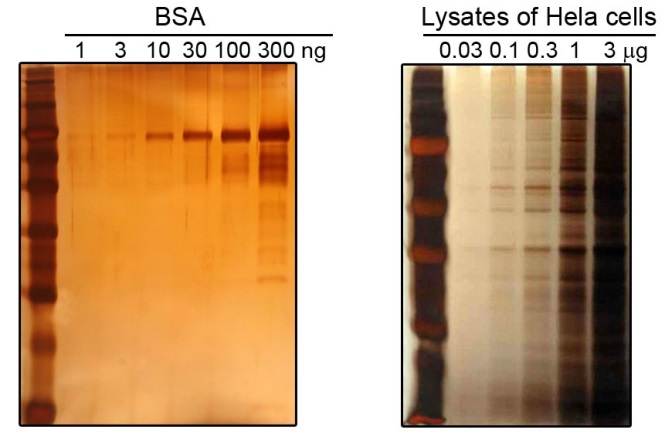
圖1. 本試劑盒PAGE膠銀染效果圖。BSA(左圖)和Hela細胞裂解液(右圖)在SDS-PAGE后使用本試劑盒進行銀染的效果圖。最左側泳道均為蛋白分子量標準。左圖為獲得較高的檢測靈敏度,顯色時間較長,已經產生了橙黃色的背景;右圖顯色時間較短,僅出現淺土黃色的背景。
無需使用有毒的甲醇。
本試劑盒可足夠用于25塊常規的8×10cm凝膠的銀染。
包裝清單:
| 產品編號 | 產品名稱 | 包裝 |
| P0017S-1 | 銀染增敏液(100X) | 26ml |
| P0017S-2 | 銀溶液(100X) | 26ml |
| P0017S-3 | 銀染基本顯色液(5X) | 125ml×4 |
| P0017S-4 | 銀染顯色加速液(2000X) | 1.5ml |
| P0017S-5 | 銀染終止液(20X) | 125ml |
| — | 說明書 | 1份 |
保存條件:
室溫保存,一年有效。銀溶液(100X)和銀染顯色加速液(2000X)需避光保存。
注意事項:
由于銀染非常靈敏,操作時請注意盡量使用高純度的水,并確保所使用的器皿非常清潔,最好使用潔凈的玻璃器皿。操作時必須戴手套,避免皮膚和凝膠直接接觸。
需自備乙醇、乙酸及Milli-Q級純水或雙蒸水。
下述使用說明中各種溶液的使用量適用于大小為8×10cm厚度為0.75-1mm的凝膠。對于更大的凝膠,各種溶液的使用量需按凝膠面積的比例放大,對于更厚的凝膠,作用時間需按照厚度的比例適當延長。
本說明書所指的室溫為20-25℃,操作溫度較低時由于溶液的擴散能力下降,各步驟需適當延長時間。
銀染基本顯色液(5X)在低溫環境下可能會出現少量沉淀,可在30-50℃水浴中溶解,并充分混勻后使用。至少后續稀釋至1X后須確保完全溶解。
本產品僅限于專業人員的科學研究用,不得用于臨床診斷或治療,不得用于食品或藥品,不得存放于普通住宅內。
為了您的安全和健康,請穿實驗服并戴一次性手套操作。
使用說明:
1. 固定:
電泳結束后,取凝膠放入約100ml固定液中,在搖床上室溫搖動20分鐘,搖動速度為60-70rpm。固定40分鐘以上甚至過夜可以進一步降低背景。
固定液的配制:依次加入50ml乙醇、10ml乙酸和40ml Milli-Q級純水或雙蒸水,混勻后即成100ml固定液。
2. 30%乙醇洗滌:
棄固定液,加入100ml 30%乙醇,在搖床上室溫搖動10分鐘,搖動速度為60-70rpm。
30%乙醇的配制:70ml Milli-Q級純水或雙蒸水中加入30ml乙醇,混勻后即成100ml 30%乙醇。
3. 水洗滌:
棄30%乙醇,加入200ml Milli-Q級純水或雙蒸水,在搖床上室溫搖動10分鐘,搖動速度為60-70rpm。如果本步驟用水洗滌更長時間,對降低染色的背景略有幫助。
4. 增敏:
棄水,加入100ml銀染增敏液(1X),在搖床上室溫搖動2分鐘,搖動速度為60-70rpm。
銀染增敏液(1X)的配制:99ml Milli-Q級純水或雙蒸水中加入1ml銀染增敏液(100X),混勻后即為銀染增敏液(1X)。銀染增敏液(1X)配制后需在2小時內使用。
5. 水洗滌(共2次):
棄原有溶液,加入200ml Milli-Q級純水或雙蒸水,在搖床上室溫搖動1分鐘,搖動速度為60-70rpm。
棄水,再加入200ml Milli-Q級純水或雙蒸水,在搖床上室溫搖動1分鐘,搖動速度為60-70rpm。
6. 銀染:
棄水,加入100ml銀溶液(1X),在搖床上室溫搖動10分鐘,搖動速度為60-70rpm。
銀溶液(1X)的配制:99ml Milli-Q級純水或雙蒸水中加入1ml銀溶液(100X),混勻后即為銀溶液(1X)。銀溶液(1X)配制后需在2小時內使用。
7. 水洗滌:
棄原有溶液,加入100ml Milli-Q級純水或雙蒸水,在搖床上室溫搖動1-1.5分鐘,搖動速度為60-70rpm。
注意:水洗滌的時間不能超過1.5分鐘。
8. 顯色:
棄水,加入100ml銀染顯色液,在搖床上室溫搖動3-10分鐘,直至出現比較理想的預期蛋白條帶,搖動速度為60-70rpm。
銀染顯色液的配制:80ml Milli-Q級純水或雙蒸水中加入20ml銀染基本顯色液(5X),再加入0.05ml銀染顯色加速液(2000X),混勻后即為銀染顯色液。銀染顯色液配制后需在20分鐘內使用。
9. 終止:
棄銀染顯色液,加入100ml銀染終止液(1X),在搖床上室溫搖動10分鐘,搖動速度為60-70rpm。終止時有氣體產生屬正常現象,產生的氣體為二氧化碳。
銀染終止液(1X)的配制:95ml Milli-Q級純水或雙蒸水中加入5ml銀染終止液(20X),混勻后即為銀染終止液(1X)。銀染終止液(1X)配制后宜當天使用。
10. 水洗滌:
棄銀染終止液,加入100ml Milli-Q級純水或雙蒸水,在搖床上室溫搖動2-5分鐘,搖動速度為60-70rpm。
11. 保存:
可在Milli-Q級純水或雙蒸水中保存。或采用適當的方式制備成干膠。
常見問題:
1. 背景太深:
a. 顯色時間過長。通常顯色反應會在10分鐘內結束,顯色反應時間過長會導致背景很深。
b. 洗滌不充分。洗滌時間過短,或洗滌液加入的量不足,或者容器過于狹小導致搖動時溶液不易充分混合,或搖動速度過慢,導致混勻不充分。請按照說明書的建議確保各種溶液的用量和作用時間,搖床的推薦速度為60-70rpm。
c. 凝膠中原有的緩沖液等未在固定步驟中去除干凈。一方面需確保固定的時間和固定液的用量,另一方面對于不是最常用的Bis-Tris緩沖的凝膠需要更長的固定時間以充分去除凝膠中的原有緩沖成分,以降低背景。
d. 水的純度太低。需使用大于16 MΩ.cm的高純度水。
2. 蛋白條帶非常淺:
a. 蛋白的半胱氨酸(Cysteine)殘基的含量特別低或幾乎沒有。半胱氨酸殘基的存在對于銀染非常重要,半胱氨酸殘基的含量過低會導致檢測靈敏度下降。
b. 銀染后水洗滌時間過長。在銀溶液染色時需嚴格控制水洗滌的時間,水洗滌的時間不能超過1.5分鐘,否則會導致過多的銀離子被洗去,導致檢測靈敏度下降。
c. 上樣量不足。本試劑盒檢測BSA的靈敏度可以達到0.3ng,對于不同的蛋白檢測靈敏度可能不同。對于一些蛋白可能需要大于1ng的蛋白量才能被檢測到。
d. 固定步驟后的洗滌不夠充分。導致少量乙酸殘留,影響后續檢測。確保30%乙醇洗滌和水洗滌的用量和時間,可以適當延長洗滌時間。
3. 凝膠上出現小點或或其它非蛋白的痕跡:
a. 凝膠沒有充分被溶液浸沒。請注意選擇大小合適的容器,并加入足量的各種溶液,同時需保持適當的混勻速度確保凝膠可以被溶液浸沒。
b. 用于銀染的容器沒有充分洗滌干凈。容器需先用洗滌劑充分洗滌,隨后用自來水充分沖洗,最后用高純度水再洗滌數次。該容器最好能專用于銀染,并注意避免各種可能的蛋白污染。為確保充分洗滌干凈,對于耐硝酸的容器,例如玻璃容器,可以在上述洗滌劑及自來水洗滌后用50%硝酸洗滌,隨后用高純度水充分洗滌。
c. 指紋或其它壓痕。請注意戴手套操作,切勿直接接觸皮膚。操作時請注意盡量勿擠壓、折疊或摩擦凝膠。
d. 有金屬物質接觸凝膠。金屬物質例如金屬鑷子等接觸凝膠會出現非特異性痕跡。
4. 在60-70 kD處出現一片模糊的蛋白染色背景:
皮膚上脫落的角蛋白(keratin)污染了蛋白樣品。一方面需注意戴手套操作,另一方面需注意盛放蛋白樣品的容器蓋子盡量不要敞開,甚至在取放蛋白樣品時在超凈臺內進行以避免可能的角蛋白污染。
5. 在凝膠的頂端處出現黃色背景:
a. 樣品中DTT濃度很高。采用其它適當的還原試劑,或者在許可范圍內適當減少DTT的用量。
b. 采用Tris-Glycine-SDS電泳體系。Tris-Glycine-SDS電泳體系中的Glycine會導致背景凝膠的頂端出現輕微的黃色背景。換用Tris-Tricine-SDS電泳體系則可顯著消除此黃色背景。
6. 銀在染色器皿中出現沉淀:
染色器皿中可能含有殘余的洗滌劑或上次銀染時的殘余試劑。需確保把染色器皿洗滌干凈。