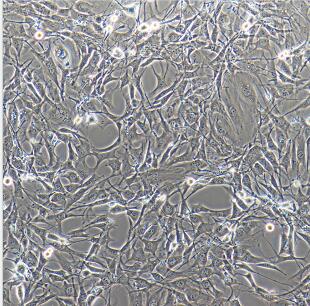
| 傳代方法 | 第一次建議1:2傳代 | 凍存條件 | 無血清凍存液(貨號:C7001) |
| 細胞描述 | 本庫的細胞僅用于科研工作,未經許可不得用于其他目的,使用者不得將本庫細胞轉讓給第三者。 | ||
| 培養備注 | 用無菌離心管收集瓶子培養基,留作過渡培養 | ||
細胞收到后處理
培養至良好狀態后灌滿完全培養液并封好瓶口是運輸細胞的最好辦法。收到細胞用75%酒精噴灑整個細胞瓶,消毒后放到超凈臺內嚴格無菌操作,將細胞瓶放入37℃、5%CO2的培養箱中靜置3-4小時以穩定細胞狀態后再做處理。顯微鏡觀察細胞生長情況,并對細胞進行不同倍數拍照保存(最好40x,100x,200x各一張),前三天照片是重要售后依據,不提供照片默認收到狀態良好。(注意密封培養瓶放入培養箱時要將蓋子擰松,傳代后建議一瓶用原瓶的完全培養基,另外一瓶用自己配的完全培養基,以便進行對比培養)
細胞培養步驟
一、復蘇細胞:將含有1mL細胞懸液的凍存管在37℃水浴中迅速搖晃解凍,加入5mL培養基混合均勻。在1000RPM條件下離心5分鐘,棄去上清液,補加4-6mL完全培養基后吹勻。然后將所有細胞懸液加入培養瓶中培養過夜(或將細胞懸液加入6cm皿中),培養過夜。第二天換液并檢查細胞密度。
二、細胞傳代:如果細胞密度達80%-90%,即可進行傳代培養。
a)、對于貼壁細胞,傳代可參考以下方法:
1. 棄去培養上清,用不含鈣、鎂離子的PBS潤洗細胞1-2次。
2. 加1-2ml消化液(0.25%Trypsin-0.53mM EDTA)于培養瓶中,置于37℃培養箱中消化1-2min,然后在顯微鏡下觀察細胞消化情況,若細胞大部分變圓并脫落,迅速拿回操作臺,輕敲幾下培養瓶后加5ml以上含10%血清的完全培養基終止消化。
3.輕輕吹打細胞,完全脫落后吸出,在1000RPM條件下離心8-10分鐘,棄去上清液,補加1-2mL培養液后吹勻。
4. 按5-6ml/瓶補加培養液,將細胞懸液按1:2的比例分到新的含5-6 ml培養液的新皿中或者瓶中。
b)、對于懸浮細胞,傳代可參考以下方法:
方法一:收集細胞,1000RPM條件下離心8-10分鐘,棄上清液,補加1-2ml培養液后吹勻,將細胞懸液按1:2到1:5的比例分到新的含8ml培養基的新皿中或瓶中。
方法二:可選擇半數換液方式,棄半數培養基后,將剩余細胞懸起,將細胞懸液按1:2到1:3的比例分到新的含8ml培養基新皿中或者瓶中。
PS:若客戶收到2ml小管細胞,收到細胞后,用75%酒精噴灑整個管子消毒后放到超凈臺或安全柜內,嚴格無菌操作;將小管細胞轉移至T25培養瓶或6cm培養皿,加入5ml左右完全培養基混勻,放入培養箱過夜培養后查看細胞密度:若密度未超過80%,換液繼續培養,視情況傳代或者凍存。若密度超過80%,可直接進行傳代(方法同上)。
三、細胞凍存:
1、細胞生長至覆蓋培養瓶的80%面積時,棄T25培養瓶中的培養液,用PBS清洗細胞一次;
2、添加0.25%胰蛋白酶消化液約1ml至培養瓶中,倒置顯微鏡下觀察,待細胞回縮變圓后加入5ml完全培養液終止消化,再輕輕吹打細胞使之脫落,然后將懸液轉移至15ml離心管中,1000rpm離心 5min;
3、 棄上清,沉淀細胞加入1ml的雅吉生物無血清凍存液(貨號:C7001),混勻后加入凍存管中。
4、 將凍存細胞直接放入-80℃冰箱即可,如后期要將細胞轉入液氮罐中,則需在-80℃冰箱 中存放24小時以上再轉入液氮罐中。